Calendario de vacunaciones del adolescente
Calendario de vacunaciones del adolescente
F.A. Moraga-Llop. Pediatra. Vicepresidente primero de la Asociación Española de Vacunología. Miembro del Consejo Asesor de Vacunaciones del Departamento de Salud de la Generalitat de Cataluña. Asesor externo del Comité Asesor de Vacunas de la Asociación Española de Pediatría.
Adolescere 2021; IX (2): 14-23
Resumen
|
El calendario de vacunaciones del adolescente se ha enriquecido en los últimos años con la autorización de nuevas vacunas. Sus coberturas vacunales son más bajas, en todos los países, que las correspondientes a los primeros 2 años de la vida, cuando el niño tiene mucho más contacto con el sistema sanitario. Existen tres propuestas de calendario de vacunaciones sistemáticas del adolescente: la del Consejo Interterritorial del Sistema Nacional de Salud, la de la Asociación Española de Pediatría (que como sociedad científica que incluye la medicina de la adolescencia es la que consultan la mayoría de los pediatras), y la tercera, un calendario «de máximos» que considera las vacunas autorizadas y disponibles en el momento actual. Además, existe un calendario de los adolescentes no vacunados o insuficientemente inmunizados y otro del calendario del adolescente viajero. La información prevacunal a los adolescentes y a sus padres por parte del pediatra y del personal de enfermería, y en general de todos los profesionales sanitarios, acerca de todas las vacunas, es un aspecto que debe ser priorizado y nunca hay que olvidar. Palabras clave: Adolescencia; Calendarios de vacunaciones; Vacunas; Vacunas antimeningocócicas; Vacunas del viajero; Vacunas frente al virus del papiloma humano. |
Abstract
|
The adolescent vaccination schedule has been enriched in recent years with the authorization of new vaccines. In all countries their vaccination coverage is lower than the corresponding to the first 2 years of life, when the child has more contact with the healthcare system. There are three proposals for a systematic vaccination schedule for adolescents: that of the Interterritorial Council of the National Health System, that of the Spanish Association of Pediatrics (which as a scientific society that considers adolescent medicine is the one consulted by most pediatricians), and the third, a “maximum” schedule that includes the vaccines authorized and available at the present time. In addition, there is a calendar for unvaccinated or insufficiently immunized adolescents and another for the traveling adolescent. Prevaccination information about all vaccines to adolescents and their parents provided by the pediatrician, nursing staff and by all health professionals, is an aspect that must be prioritized and must never be forgotten. Key words: Adolescence; Vaccination schedules; Vaccines; Meningococcal vaccines; Traveler’s vaccines; Vaccines against the human papillomavirus. |
Introducción
Los progresos en el calendario pediátrico de vacunaciones sistemáticas en la última década afectan a los dos extremos de la edad pediátrica: por una parte, a la protección del recién nacido y del lactante menor de 3 meses, con la incorporación de las vacunas de la embarazada, y por otra, a las inmunizaciones del adolescente, que también se han incrementado por las nuevas vacunas autorizadas.
El calendario de vacunaciones del adolescente se ha enriquecido en los últimos años con la autorización de nuevas vacunas
El calendario de vacunaciones del adolescente se ha enriquecido en los últimos años con la autorización de nuevas vacunas: dos vacunas triples bacterianas de baja carga antigénica del componente Bordetella pertussis (Tdpa3 y Tdpa5 [tétanos, difteria con toxoide tipo adulto, tosferina con componentes acelulares de carga antigénica reducida], tricomponente y pentacomponente para la tosferina, respectivamente), una vacuna combinada Tdpa3-VPI (vacuna de la poliomielitis inactivada), una vacuna tetravírica (sarampión, rubeola, parotiditis y varicela), tres vacunas frente al virus del papiloma humano (VPH) (bivalente, tetravalente y nonavalente), cuatro vacunas antigripales tetravalentes (una de ellas preparada en cultivos celulares) y las vacunas frente a cinco serogrupos de Neisseria meningitidis (tres conjugadas frente al serogrupo C, tres tetravalentes conjugadas frente a los serogrupos A, C, W e Y, y dos frente al serogrupo B).
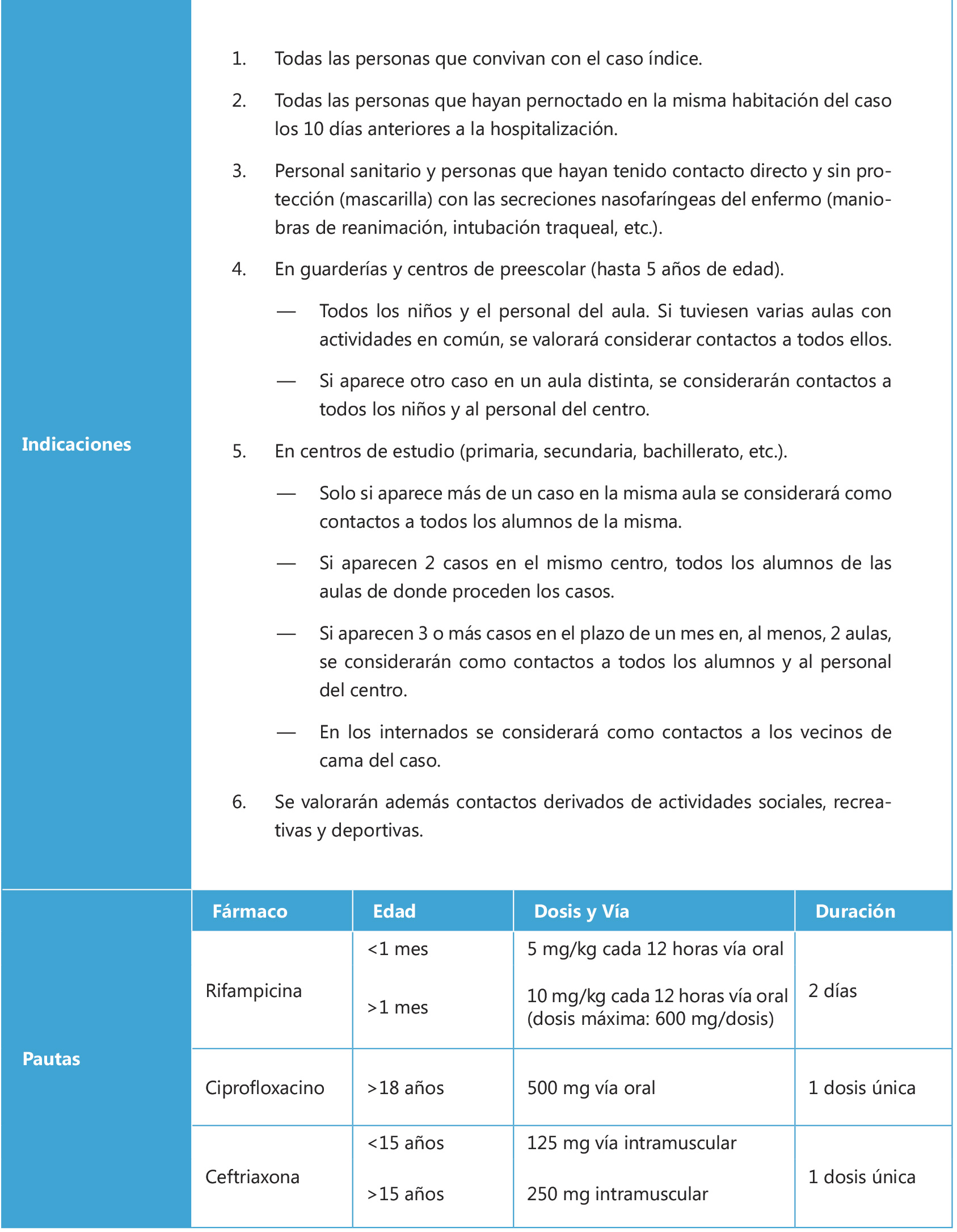
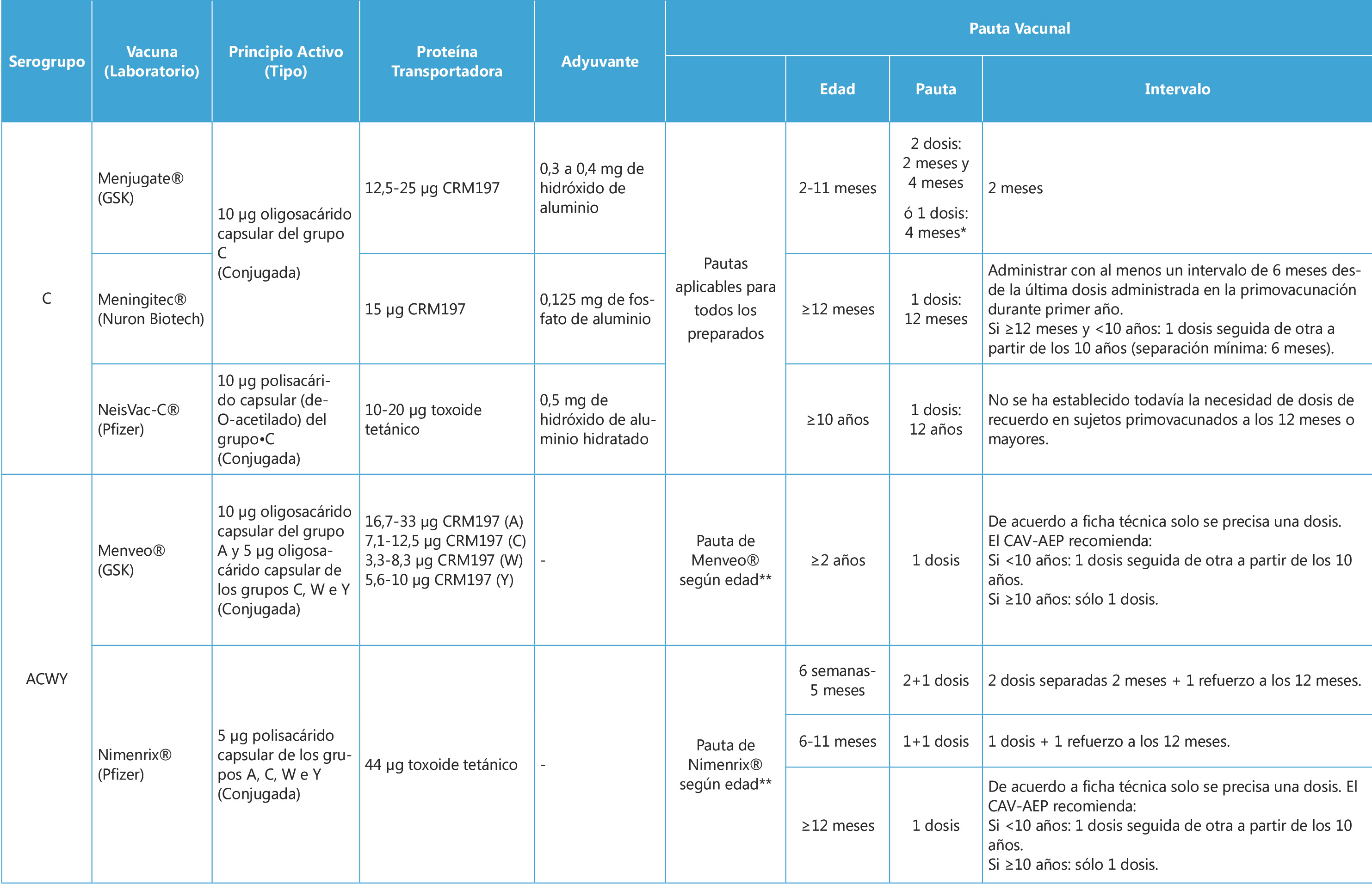
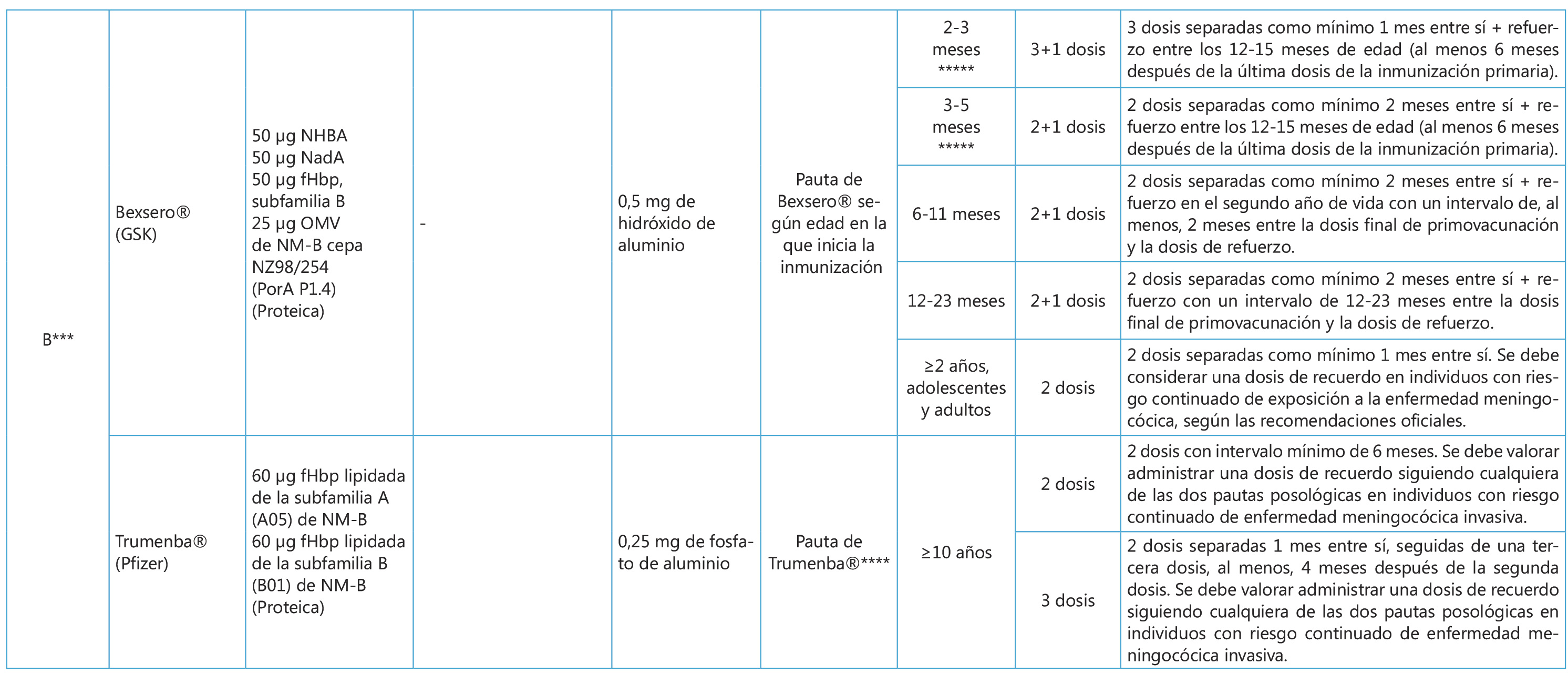
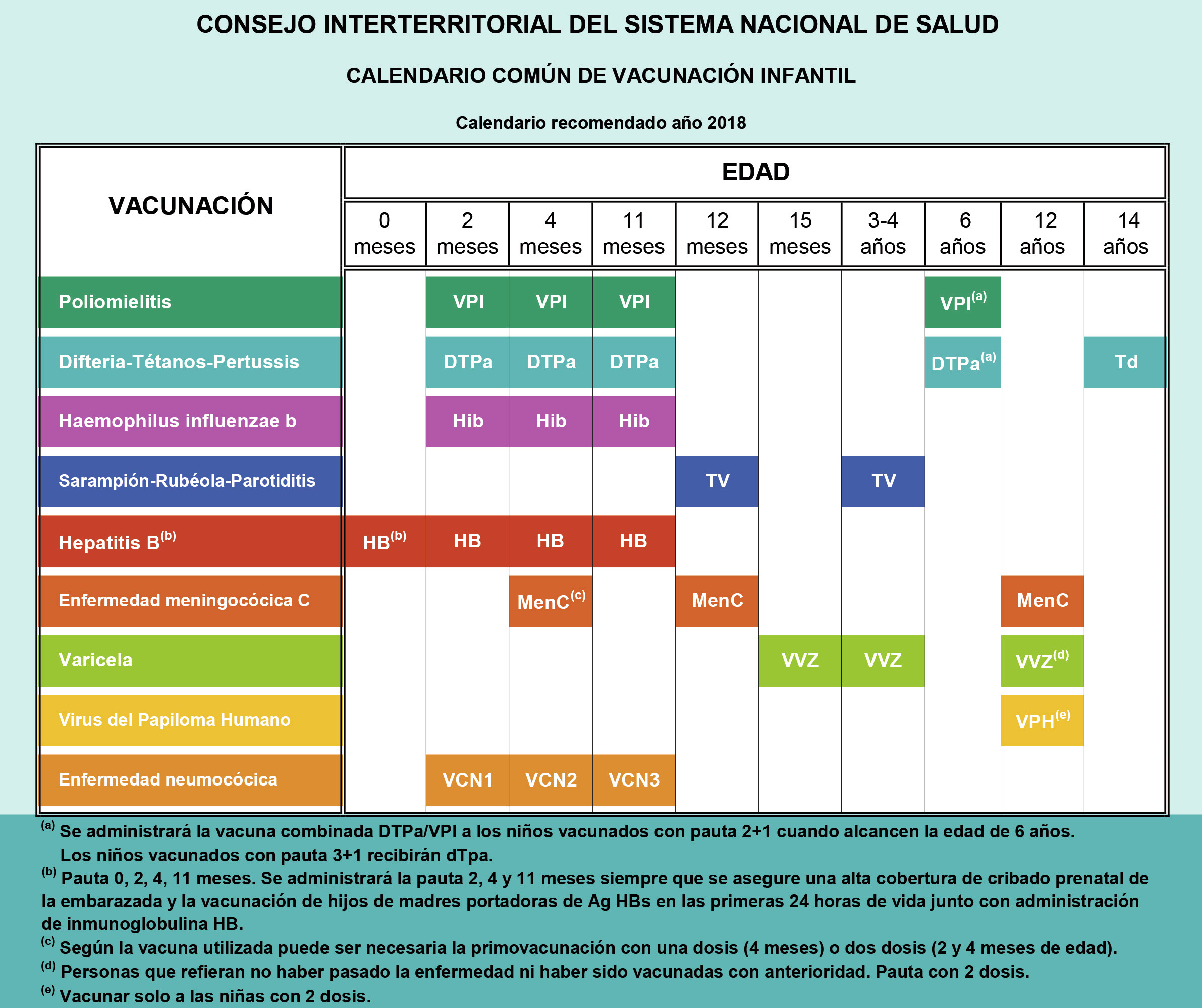
La importancia de la inmunización del adolescente debe considerarse en primer lugar en la historia clínica. La anamnesis debe contemplar los antecedentes de las vacunaciones recibidas, es decir, los tipos de vacunas, las dosis y las fechas de administración, con la finalidad de continuarlas o completar las que falten, y anotarlas o registrarlas correctamente en el carnet vacunal. Existen tres propuestas de calendario de vacunaciones sistemáticas del adolescente: la del Consejo Interterritorial del Sistema Nacional de Salud (SNS, 2021), en la que se basan los 17 calendarios de las comunidades autónomas y de las dos ciudades autónomas; la de la Asociación Española de Pediatría (AEP, 2021), que como sociedad científica que incluye la medicina de la adolescencia es la que consultan la mayoría de los pediatras; y una tercera, un calendario «de máximos», con las vacunas autorizadas y disponibles en el momento actual (2021) (Tabla I). Además, existe un calendario para los adolescentes no vacunados o insuficientemente inmunizados, y las vacunaciones del adolescente viajero.
Existen tres propuestas de calendario de vacunaciones en el adolescente: el del Consejo interterritorial del SNS, el de la AEP y un calendario «de máximos»
Las vacunaciones del adolescente en circunstancias especiales deben atenerse, en general, a las mismas recomendaciones y normas que en otras edades de la vida. Las situaciones más importantes son los pacientes con enfermedades crónicas, aquellos con trastornos de la inmunidad y las adolescentes embarazadas. Deben considerarse también en esta etapa de la vida las recomendaciones de vacunación como profilaxis posexposición frente a enfermedades de transmisión sexual, así como las inmunizaciones del viajero.
Las últimas coberturas vacunales de los adolescentes en España publicadas por el Ministerio de Sanidad corresponden al año 2019 (no se dispone de los datos de cinco comunidades autónomas) y son las siguientes:
- sexta dosis de vacuna Td a los 14 años de edad, 83,4%;
- vacunación frente al VPH a los 11-12 años, 79% (75,1% y 91% como valores extremos de las comunidades autónomas), pero el 89,3% han recibido la primera dosis; y
- meningococo del serogrupo C a los 12 años, 88,5% (13,3% vacunados con vacuna ACWY).
Estas coberturas son más bajas en todos los países, que las correspondientes a los primeros 2 años de la vida, cuando el niño tiene mucho más contacto con el sistema sanitario y acude con más frecuencia y regularidad a las visitas de control del niño sano que más tarde en la adolescencia. Por esto es crucial que la vacunación del adolescente, para alcanzar y mantener unas altas coberturas vacunales, se realice en la escuela, como se ha demostrado, por ejemplo, con el programa de vacunación de la hepatitis B en el adolescente en Cataluña durante 25 años. Además, la información prevacunal a padres y adolescentes por parte del pediatra y del personal de enfermería y de farmacia, y en general de todos los profesionales sanitarios acerca de todas las vacunas, es un aspecto que debe ser priorizado y nunca hay que olvidar.
Vacunaciones de rescate
Al realizar la anamnesis vacunal al adolescente hay que interrogar sobre las vacunas y las dosis que ha recibido para verificar si el calendario de la comunidad donde reside está al día, y se le solicitará el carnet vacunal
Al realizar la anamnesis vacunal al adolescente hay que interrogar sobre las vacunas y las dosis que ha recibido para verificar si el calendario de la comunidad donde reside está al día, y se le solicitará el carnet vacunal. Sin embargo, la vacuna triple vírica, la vacuna de la varicela y las vacunas de las hepatitis B y A han formado parte, en algún momento, de los calendarios del adolescente, pero ahora se incluyen en el calendario del lactante (hepatitis B) o del niño (triple vírica, varicela y en algunas comunidades hepatitis A), por lo que deberá confirmarse que se han administrado, ya que durante un tiempo coexistieron o se solaparon en los dos calendarios.
La vacuna frente al VPH se administra preferentemente a los 11-12 años porque se considera que es la edad óptima (se adelanta a los 9 años en los grupos de riesgo). Su recomendación es también aplicable a edades posteriores, en caso de retraso en su administración, dados los beneficios que puede seguir aportando, por lo que se incluye en este apartado de las vacunaciones de rescate durante la adolescencia; rescate que también debe ser considerado en la edad adulta.
Vacuna triple vírica, vacuna de la varicela y vacuna tetravírica
El sarampión, la rubeola y la parotiditis son tres enfermedades cuya incidencia ha disminuido de forma importante desde 1987, gracias a la introducción de la vacunación sistemática con la vacuna triple vírica en 1981, a los 12-15 meses de edad (Cataluña la había incluido en 1980 a los 12 meses de edad). En 1988, el Departamento de Sanidad y Seguridad Social de la Generalitat de Cataluña introdujo una segunda dosis de esta vacuna a los 11 años de edad para niños y niñas, sustituyendo a la de la rubeola que se administraba a las niñas. Esta estrategia fue seguida posteriormente por todas las comunidades autónomas y figuró en el calendario del Consejo Interterritorial del SNS de 1995. Con esta inmunización se iniciaba el calendario universal (chicos y chicas) de vacunaciones del adolescente.
La segunda dosis de vacuna triple vírica se implantó con dos objetivos: 1) aumentar la cobertura vacunal de la población al inmunizar a todos los niños susceptibles por no estar vacunados previamente o por disminuir el fallo vacunal primario (eficacia del 95%), y 2) reforzar la inmunidad al conseguir un efecto booster que aumenta el título de anticuerpos, con lo cual se logra una protección más duradera, sobre todo en los escasos casos de fallo secundario. En 1999 se acordó adelantar la segunda dosis a los 3-6 años de edad, preferentemente a los 3-4 años, como parte del plan para la eliminación del sarampión, con el fin de que no hubiera niños susceptibles en edad escolar. De esta manera, dejó de ser una vacuna del calendario del adolescente.
En el segundo estudio de seroprevalencia en España 2017-2018, publicado por el Ministerio de Sanidad en 2021, se observa en la población de 10 a 14 años que un 8,6% son susceptibles a la varicela. En el mismo estudio se constata, para el sarampión, un descenso paulatino de la seroprotección, con una tasa por debajo del 95%, a partir de los 10 años de edad y hasta los 39 años (90,2% en la población de 15 a 19 años y 86,9% en la de 20 a 29 años); esta caída de la protección puede deberse a una pérdida de anticuerpos con el tiempo, a partir del momento de la segunda dosis. Es muy importante, pues, comprobar el estado vacunal frente a estas dos enfermedades al considerar el calendario del adolescente.
En los últimos años estamos asistiendo a una reemergencia del sarampión en muchos países europeos y en todo el mundo
En los últimos años estamos asistiendo a una reemergencia del sarampión en muchos países europeos y en todo el mundo. En cuanto a la rubeola, hay que señalar la alta tasa de susceptibilidad en la población inmigrante en edad fértil, debido a que en sus países de origen se utiliza casi siempre la vacuna monovalente del sarampión.
En este momento, la vacuna triple vírica forma parte del calendario del adolescente entre las vacunaciones de recuperación, y cabe recordar que no existen vacunas monovalentes frente a las tres enfermedades. Hay que vacunar con dos dosis separadas en un intervalo mínimo de 1 mes, si no se han administrado previamente las dos dosis de vacuna triple vírica después de los 12 meses de edad. Si el niño ya había recibido una primera dosis pasada esta edad, se administrará la dosis restante. Se utilizará la vacuna tetravírica si hay que vacunar también de la varicela.
En relación con los brotes de parotiditis, en los Estados Unidos se ha recomendado (desde enero de 2018) la administración de una tercera dosis de vacuna triple vírica en estas situaciones para las personas de alto riesgo que determinen las autoridades sanitarias.
La varicela es, en la actualidad, la enfermedad exantemática más frecuente en la población infantil en los países desarrollados
La varicela es, en la actualidad, la enfermedad exantemática más frecuente en la población infantil en los países desarrollados, tras la disminución de la incidencia del sarampión y de la rubeola debido a la inmunización sistemática con la vacuna triple vírica. Desde el calendario de 2005 hasta el de 2017 del Consejo Interterritorial del SNS, la vacuna de la varicela ha figurado en la adolescencia, a los 12 años, para quienes refieran no haber pasado la enfermedad ni haber sido vacunados con anterioridad con dos dosis. En el calendario de la AEP del año 2001 ya se incluyó a los 12-15 meses con un rescate a los 11-12 años. Se utilizará la vacuna tetravírica si hay que vacunar también del sarampión, la rubeola o la parotiditis.
Vacunas antihepatitis B y A y vacuna combinada hepatitis A+B
La infección por el virus de la hepatitis B es una de las causas más importantes de hepatitis aguda y crónica, cirrosis y carcinoma hepatocelular primario. El mayor riesgo de enfermedad crónica se observa cuando se contrae la infección en el periodo perinatal (70-90%), es más bajo en los menores de 5 años (20-50%) y aún más en los niños mayores y en los adultos (5-10%).
La infección por el virus de la hepatitis B es una de las causas más importantes de hepatitis aguda y crónica, cirrosis y carcinoma hepatocelular primario
Cataluña fue la primera comunidad autónoma en iniciar un programa de inmunización frente a la hepatitis B. En 1985 se puso en marcha un programa dirigido a determinados grupos que tienen un alto riesgo de padecer la enfermedad, como los recién nacidos hijos de madres portadoras del virus (HBsAg positivas) y las personas en contacto íntimo (convivientes y parejas sexuales) con portadores crónicos. En 1986 se aprobó el programa de inmunización pasiva y activa de los recién nacidos hijos de madres HBsAg positivas. En 1990 se consideró que, para obtener un impacto eficaz y a corto plazo sobre la incidencia de la hepatitis B, era conveniente implantar la vacunación en la adolescencia, ya que el riesgo de infección por este virus es bajo durante la edad infantil, pero aumenta de manera considerable a partir de la adolescencia, entre los 14 y los 25 años de edad, con el inicio de las relaciones sexuales y las conductas de riesgo, tal como mostraban los resultados de las encuestas seroepidemiológicas realizadas en Cataluña. Durante el curso 1991-1992 se inició la vacunación antihepatitis B de los niños y niñas de 11-12 años en las escuelas, y se incorporó al calendario de inmunizaciones.
En 1990 se consideró que, para obtener un impacto eficaz y a corto plazo sobre la incidencia de la hepatitis B, era conveniente implantar la vacunación en la adolescencia, ya que el riesgo de infección por este virus es bajo durante la edad infantil, pero aumenta de manera considerable a partir de la adolescencia
Posteriormente, la vacuna de la hepatitis B se introdujo en el calendario de inmunizaciones sistemáticas de todas las comunidades autónomas en el primer año de vida, con dos pautas: 0, 2 y 6 meses, o 2, 4 y 6 meses (desde 2016-2017 la pauta es 2+1, a los 2, 4 y 11 meses, vigente en todas las comunidades autónomas). Canarias y Cataluña fueron las dos últimas comunidades que hasta el año 2002 mantuvieron una estrategia vacunal exclusiva en el adolescente (11-12 años) y en los recién nacidos hijos de madre portadora.
La hepatitis A en los niños casi siempre tiene un curso leve (asintomática o con manifestaciones inespecíficas moderadas, sin ictericia), mientras que en los adolescentes y los adultos es sintomática (ictericia) y de mayor gravedad
La hepatitis A es una enfermedad infectocontagiosa que en los niños casi siempre tiene un curso leve (asintomática o con manifestaciones inespecíficas moderadas, sin ictericia), mientras que en los adolescentes y los adultos es sintomática (ictericia) y de mayor gravedad. Su prevalencia varía de manera importante de unos países a otros en relación con las condiciones higiénicas, sanitarias y socioeconómicas de la población. A medida que estas mejoran, disminuye la seroprevalencia en la población infantil, lo cual origina un cambio en el patrón epidemiológico de la infección, caracterizado por un desplazamiento de la curva de prevalencia de anticuerpos hacia edades más avanzadas, que da lugar a un incremento paulatino de la población adulta joven susceptible, en la que la enfermedad es más grave.
Desde 1993 se comercializa en España la vacuna monovalente contra la hepatitis A, y desde 1997 la combinada contra las hepatitis A y B, que facilita su incorporación al calendario de inmunizaciones sistemáticas, como ha ocurrido en Cataluña desde el curso escolar 1997-1998, donde se desarrolla un programa piloto de vacunación contra las hepatitis A y B en las escuelas, a los 11-12 años de edad, sustituyendo a la vacuna monovalente de la hepatitis B. De esta forma, al reducirse la incidencia de la infección por el virus de la hepatitis A en la infancia, también se prevendrá la enfermedad en los adultos que la adquieren a partir de los niños. Este programa piloto finalizó cuando la primera cohorte de lactantes vacunados de hepatitis B a partir de los 2 meses de edad llegó a la adolescencia (curso 2014-2015); a partir de entonces se ha continuado solo con la vacuna de la hepatitis A y se ha incorporado al calendario de vacunaciones sistemáticas a otras dos cohortes, a los 15 meses y a los 6 años. Ceuta y Melilla también la tienen en su calendario en el segundo año de vida. El resto de las comunidades autónomas solo la administran a los grupos de riesgo. Las elevadas inmunogenicidad, seroprotección y efectividad de esta vacuna, como se ha demostrado en Cataluña en los últimos 20 años, junto con la eficiencia de la vacunación, la aconsejan en el calendario del adolescente mientras no sea una vacuna sistemática en la infancia. Además, según los últimos estudios publicados, en un futuro próximo es posible que pueda administrarse en una pauta de una sola dosis.
La vacunación puede realizarse, según los casos, con las vacunas monovalentes de las hepatitis B o A, o con la combinada de las hepatitis A+B.
Calendarios de vacunación del adolescente
Calendario común de vacunación a lo largo de toda la vida del Consejo Interterritorial del Sistema Nacional de Salud (2021)
Se incluyen las siguientes vacunaciones en el adolescente:
- Vacuna antimeningocócica tetravalente ACWY a los 12 años.
- Vacuna frente al virus varicela-zóster, con dos dosis en quienes refieran no haber pasado la enfermedad ni haber sido vacunados con anterioridad con dos dosis.
- Vacuna frente al VPH a los 12 años solo en las chicas.
- Vacuna Td (tétanos y difteria con toxoide tipo adulto) a los 14 años.
- Vacunaciones de rescate a los 15-18 años: Td, triple vírica, hepatitis B, antimeningocócica ACWY, varicela y VPH.
Según acuerdo de la Comisión de Salud Pública (14 de marzo de 2019), en la vacunación a los 12 años de edad se sustituirá la vacuna frente al meningococo C por la vacuna tetravalente frente a los meningococos A, C, W e Y. Esta sustitución se llevará a cabo de forma gradual y deberá estar implementada en todo el territorio a lo largo de 2020 (calendario de vacunación de 2020). Además, se realizará una captación activa y la vacunación de varias cohortes de adolescentes y adultos jóvenes. Con la finalidad de establecer una protección comunitaria, se hará una vacunación de rescate de manera coordinada en todas las comunidades, durante 2-3 años, para cubrir la población hasta los 18 años de edad.
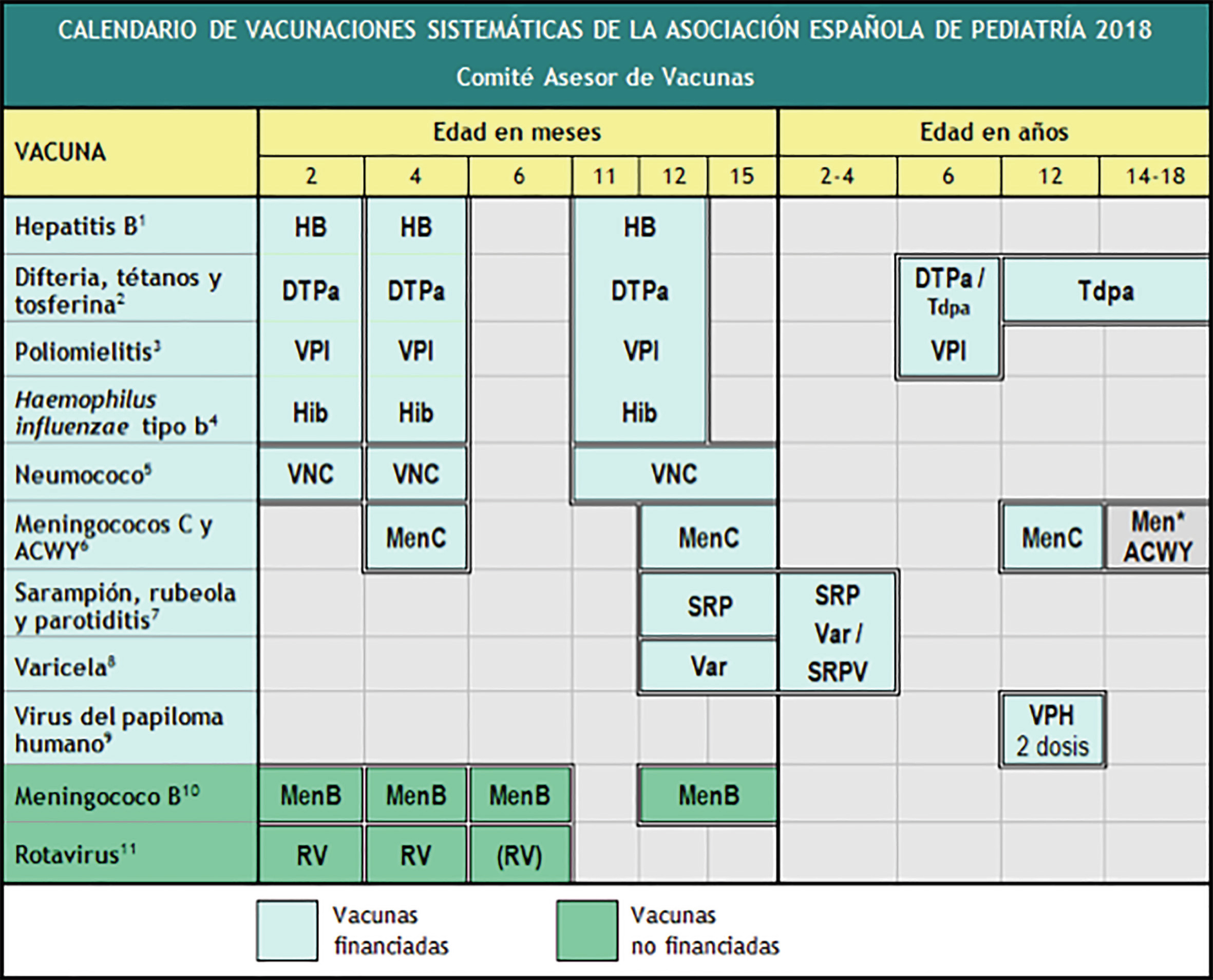
Calendario de la Asociación Española de Pediatría (2021)
Se incluyen las siguientes vacunaciones sistemáticas:
- Vacuna Tdpa a los 12-14 años.
- Vacuna antimeningocócica tetravalente ACWY a los 12-18 años.
- Vacuna universal frente al VPH, tanto a chicas como a chicos, preferentemente a los 12 años.
Calendario «de máximos» (2021)
Con las vacunas disponibles en España puede elaborarse un calendario «de máximos» (Tabla I), en el que figuran aquellas vacunas que se consideran recomendables para el adolescente, algunas financiadas por el SNS y otras no, ya que la recomendación individual no coincide siempre con la sistemática, debido sobre todo a criterios de eficiencia
Con las vacunas disponibles en España puede elaborarse un calendario «de máximos» (Tabla I), en el que figuran aquellas vacunas que se consideran recomendables para el adolescente, algunas financiadas por el SNS y otras no, ya que la recomendación individual no coincide siempre con la sistemática, debido sobre todo a criterios de eficiencia. La vacuna de la hepatitis A, presente en los calendarios de Cataluña, Ceuta y Melilla, deberá administrarse lo más precozmente posible. La vacuna antigripal anual se utilizará siempre en su forma tetravalente para obtener la máxima protección.
La última novedad en este calendario es que se acaba de autorizar la primera vacuna frente al SARS-CoV-2 para adolescentes, en la franja de edad de 12 a 15 años (Comirnaty, Pfizer-BioNTech), que ya estaba autorizada a partir de los 16 años; las otras tres vacunas disponibles en España se pueden administrar a partir de los 18 años. Esta vacuna se debe incluir en el calendario del adolescente una vez se haya vacunado a toda la población de 16 años y más. Los adolescentes pertenecientes a grupos de riesgo deben vacunarse de forma prioritaria e inmediata (ver información más detallada en la cita Vacunación frente a la COVID-19 en los adolescentes. Una realidad de Moraga Llop FA).
Vacuna frente al virus del papiloma humano
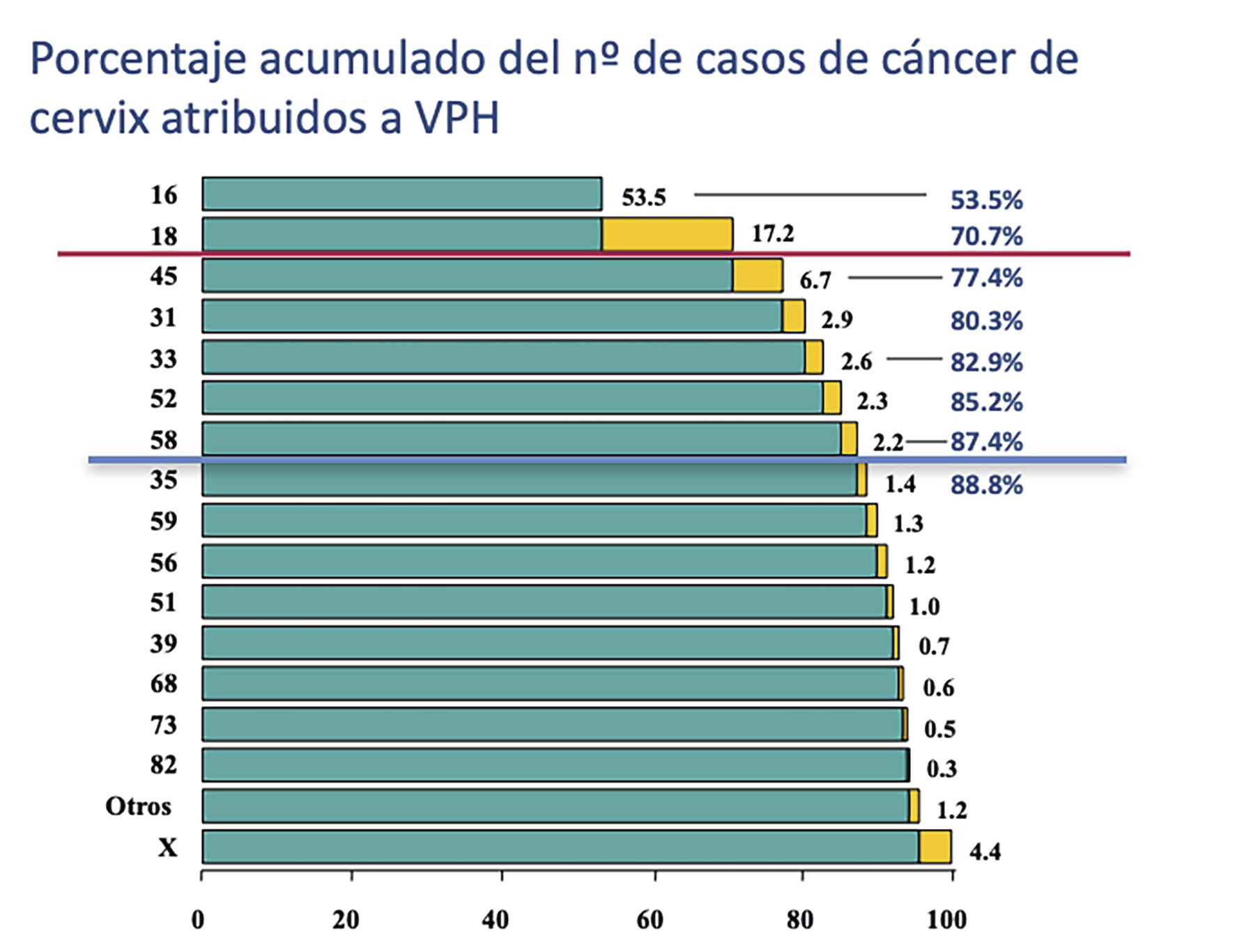
A finales de 2017 se cumplieron 10 años de la comercialización en España de las dos primeras vacunas frente al VPH, primero la tetravalente (VPH 6, 11, 16 y 18) en octubre de 2007, que ya había sido aprobada por la Food and Drug Administration (FDA) en 2006, y luego la bivalente (VPH 16 y 18) en enero de 2008. Una tercera vacuna se comercializó en mayo de 2017, la nonavalente, que amplía el espectro al incluir cinco genotipos más (VPH 31, 33, 45, 52 y 58); la FDA la había autorizado en diciembre de 2014.
El 10 de octubre de 2007, el Consejo Interterritorial del SNS recomendó, e incluyó en el calendario de ese mismo año, la vacunación sistemática de las niñas de una cohorte, a elegir entre las de 11-14 años de edad por cada comunidad autónoma en función de sus necesidades, prioridades y logística de los programas de vacunación, con un plazo de implantación hasta el año 2010. Tres comunidades iniciaron la vacunación a finales de 2007 y el resto lo hicieron durante 2008. La vacuna está en el calendario de la AEP desde 2008. En noviembre de 2017, Cataluña incorporó en su calendario la forma nonavalente, como han hecho posteriormente otras comunidades autónomas, mientras que en el resto se utiliza la bivalente o la tetravalente.
Las vacunas frente al VPH y la de hepatitis B son las únicas que previenen cánceres
En estos años de disponibilidad de vacunas frente al VPH (que junto con la vacuna de la hepatitis B son las únicas que previenen cánceres) se ha progresado en su conocimiento y se han producido avances importantes en las estrategias de vacunación, en las indicaciones y en las recomendaciones: adelanto de la edad de vacunación en el calendario, pautas de dos dosis desde los 9 hasta los 14 años (Cervarix® y Gardasil® 9) o 13 años (Gardasil®), vacunación sistemática del varón en algunos países, inmunización de la mujer más allá de la adolescencia, implementación de programas de vacunación en países en desarrollo, prevención de otras neoplasias, recomendaciones de vacunación para poblaciones de riesgo elevado de infección por el VPH, evidencia científica del impacto y la efectividad de la vacunación, y confirmación de su seguridad con más de 300 millones de dosis administradas, como ya se había observado en los ensayos clínicos.
La infección producida por el VPH es una verdadera enfermedad pandémica, por ser universal y porque afecta a mujeres y hombres a lo largo de toda la vida y en todo el mundo
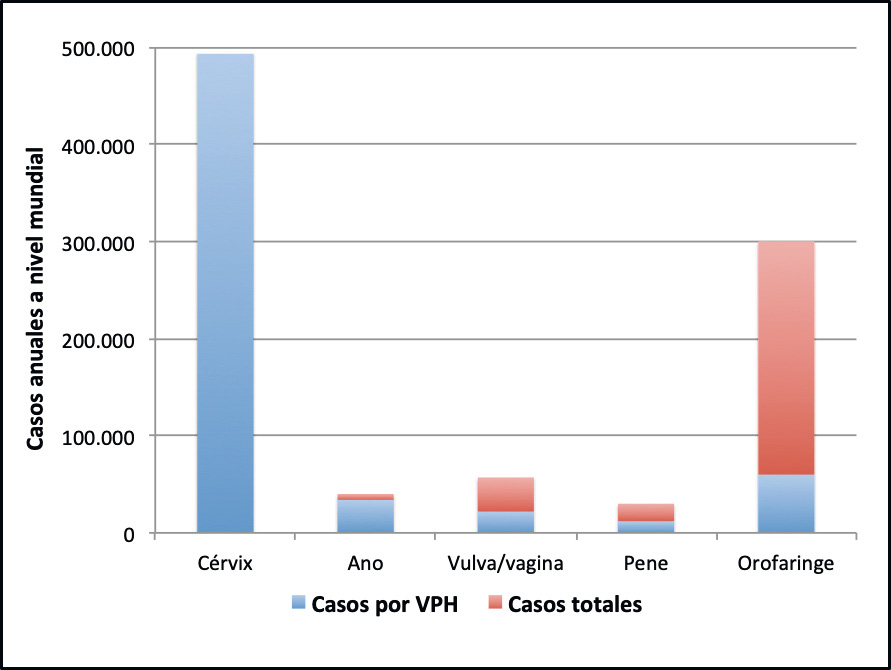
El cambio más importante en el calendario «de máximos» de la vacuna frente al VPH es la universalidad, es decir, la recomendación a chicos y chicas. La infección producida por el VPH es una verdadera enfermedad pandémica, por ser universal y porque afecta a mujeres y hombres a lo largo de toda la vida y en todo el mundo. La vacunación sistemática en el varón ya se ha implementado en muchos países. Esta inmunización previene en el hombre las verrugas anogenitales y los cánceres de ano (indicaciones ya incluidas en la ficha técnica de las vacunas tetravalentes y nonavalentes), pene, escroto y orofaringe, pero la gran justificación de la vacunación universal es la prevención de la transmisión sexual de la infección, ya que tanto el hombre como la mujer están implicados en la cadena epidemiológica y pueden ser portadores asintomáticos, transmisores y enfermos. La vacunación universal disminuirá la tasa de transmisión del VPH, aumentará la protección de grupo y conseguirá la equidad vacunal.
El papel de los profesionales de la salud vinculados con la vacunación en la adolescencia (pediatras y enfermería pediátrica) y en la edad adulta (médicos de familia y enfermería) está siendo primordial en la información y la sensibilización sobre las infecciones producidas por el VPH y su prevención, así como en la difusión y la aplicación de la vacunación, que en 2019 alcanzó en España una cobertura media completa con dos dosis del 79% (similar a la del año anterior). Si queremos disminuir la incidencia del cáncer relacionado con el VPH, debemos esforzarnos todos en aumentar las coberturas vacunales y lograr, con la vacunación sistemática de los varones, una inmunización universal.
Vacuna antimeningocócica tetravalente ACWY y vacuna antimeningocócica frente al serogrupo B
En la distribución por serogrupos, el B continúa siendo el más frecuente, pero se ha producido una emergencia del W y del Y
La epidemiología de la enfermedad meningocócica en España y en Europa en general, con algunas diferencias según los países, ha experimentado cambios importantes en la última década. Por una parte, se confirma una disminución marcada de la incidencia, y en cuanto a la distribución por serogrupos, el B continúa siendo el más frecuente, pero se ha producido una emergencia del W y del Y. El aumento de la incidencia de la enfermedad meningocócica por estos dos serogrupos en varios países de Europa, primero en el Reino Unido desde 2010, llevó en 2015 a emitir nuevas recomendaciones vacunales, al igual que en Holanda se hizo 3 años después. En España, el número de casos por los serogrupos W e Y han aumentado desde 2014-2015, pero el serogrupo B se mantiene como el más frecuente, por lo que también se hace necesario reconsiderar el calendario vacunal frente al meningococo.
El origen de la emergencia del serogrupo W fue que en el año 2000 se produjo un brote epidémico de enfermedad invasiva por este serogrupo en la peregrinación anual a La Meca. El serotipo implicado, ST-11CC82, muy virulento, se extendió a través de dos linajes diferentes a varios países africanos y a Latinoamérica, y desde allí al Reino Unido y otros países europeos.
La epidemiología de la enfermedad meningocócica después del pico de máxima incidencia del primer año de vida y los menores de 5 años, se sitúa en el grupo de 15 a 24 años
Otro dato relevante en la epidemiología de la enfermedad meningocócica en relación con el adolescente es que, en su distribución por edades, después del pico de máxima incidencia del primer año de vida y los menores de 5 años, se sitúa el grupo de 15 a 24 años (adolescentes y adultos jóvenes). Además, el número de casos en la adolescencia, representa una importante proporción del total de casos, que oscila entre el 15% en Portugal y el 32% en Noruega. Por último, hay que destacar que el mayor porcentaje de portadores nasofaríngeos de meningococo, primer estadio en la transmisión de la infección, se observa en la adolescencia, con un pico máximo a los 19 años (23,7%), lo que convierte a este grupo en el primer transmisor de la infección, además de entre los adolescentes, a los niños pequeños y a las personas mayores.
El mayor porcentaje de portadores nasofaríngeos de meningococo, primer estadio en la transmisión de la infección, se observa en la adolescencia, con un pico máximo a los 19 años (23,7%)
En el Reino Unido, las autoridades sanitarias decidieron incluir en el calendario una dosis de vacuna conjugada tetravalente frente a los serogrupos A, C, W e Y en lugar de la tercera dosis de vacuna antimeningocócica C a los 14 años (2015). En España se introdujo en marzo de 2019 en el calendario común una dosis a los 12 años, teniendo en cuenta la situación epidemiológica actual, con un aumento de la incidencia del número de casos originados por los serogrupos W e Y, pero anteriormente ya se habían establecido recomendaciones para los grupos de riesgo, en los cuales la vacuna está financiada. En el calendario de la AEP se han incluido dos dosis, a los 12 meses y a los 12-14 años, y se aconseja un rescate hasta los 19 años (2019). La comunidad de Castilla y León la tiene incorporada a los 12 meses.
En el calendario «de máximos» se incluye la vacuna frente a los serogrupos A, C, W e Y a los 12 años, en lugar de la tercera dosis de vacuna antimeningocócica C, con vacunación de rescate hasta los 18 años. Debido a que se ha observado una disminución en los títulos de anticuerpos con el paso del tiempo, se puede considerar una dosis de recuerdo en los sujetos vacunados que tengan alto riesgo de exposición a la enfermedad meningocócica, que en los Estados Unidos se indica a los 5 años. En la situación de un adolescente que hubiera sido vacunado a los 12 años con la vacuna frente al serogrupo C y que viajase a un país donde se recomienda la vacuna tetravalente, se le debería administrar esta vacuna.
En el calendario «de máximos» del adolescente y como protección individual, aunque en España las tasas de incidencia son muy bajas, se recomienda la vacuna del meningococo B a los 14-18 años
En cuanto a la vacuna antimeningocócica frente al serogrupo B, en España, por el momento (acuerdo de la Comisión de Salud Pública del 14 de marzo de 2019), las autoridades sanitarias teniendo en cuenta la situación epidemiológica actual y la información disponible sobre la vacuna, así como los criterios de eficiencia de la vacunación, solo han establecido recomendaciones para los grupos de riesgo, en los cuales la vacuna está financiada. En las comunidades de Castilla y León, y Canarias, se ha incluido en el calendario en el lactante. En el calendario de la AEP, esta vacuna se incluye como sistemática desde 2016 en el primer año de vida, a los 3 meses, hasta los 59 meses de edad, especialmente en los menores de 2 años. En el calendario «de máximos» del adolescente se incluye, basándose en las características epidemiológicas antes mencionadas, aunque en España las tasas de incidencia son muy bajas, pero a modo de protección individual. Se recomienda a los 14-18 años, preferentemente a los 14 años, con una pauta de dos dosis, con un intervalo mínimo de 1 mes con Bexsero® o de 6 meses con Trumenba®.
Calendario de los adolescentes no vacunados o insuficientemente inmunizados
Este calendario es el de las llamadas pautas de rescate o aceleradas. Al cumplimentar el calendario, hay que tener siempre en cuenta el número de dosis, la edad mínima de aplicación de cada vacuna y los intervalos mínimos entre dosis, y el principio general de la vacunología: «dosis administrada, dosis válida; no hay que reiniciar pautas, sino continuarlas y completarlas, con independencia del intervalo transcurrido desde la última dosis».
Al cumplimentar el calendario, hay que tener siempre en cuenta el número de dosis, la edad mínima de aplicación de cada vacuna y los intervalos mínimos entre dosis, y el principio general de la vacunología: «dosis administrada, dosis válida»
En la vacunación con Td, una vez completada la primovacunación con tres dosis, se recomienda utilizar la vacuna Tdpa en una de las dosis de recuerdo, aunque existen pautas que ya la utilizan en la tercera dosis de la serie primaria. Para que un adulto primovacunado en la adolescencia o más tarde, se considere completamente inmunizado frente al tétanos, debe haber recibido al menos cinco dosis de vacuna con toxoide tetánico en su vida, por lo que, tras la primovacunación, deberá recibir dos dosis de refuerzo separadas por 10 años. Hay que señalar que en el segundo estudio de seroprevalencia en España 2017-2018, se observa una disminución de las concentraciones protectoras de anticuerpos antitetánicos a partir de los 50 años y sobre todo de los 60 años.
Para que un adulto primovacunado en la adolescencia o más tarde, se considere completamente inmunizado frente al tétanos, debe haber recibido al menos cinco dosis de vacuna con toxoide tetánico en su vida
En la vacunación frente al VPH (se indican dos o tres dosis), el número de dosis varía según la edad del adolescente y el preparado vacunal. Para la vacuna bivalente, la pauta de vacunación para los adolescentes de 9 a 14 años incluye dos dosis, la segunda administrada a los 6 meses de la primera (flexible entre 5 y 13 meses). La pauta de vacunación a partir de los 15 años es de tres dosis en los meses 0, 1 y 6. Para la vacuna tetravalente, la pauta de vacunación entre los 9 y los 13 años es también de dos dosis, administradas en los meses 0 y 6, mientras que para la nonavalente el intervalo de edad es de 9 a 14 años. La pauta de vacunación posteriormente es de tres dosis en los meses 0, 2 y 6. En las personas con inmunodepresión se recomienda usar siempre la pauta de tres dosis, con independencia de la edad.
Vacunaciones del adolescente viajero
Las indicaciones de las vacunaciones en el viajero forman parte de la consulta que debe realizarse habitualmente en los centros de vacunación internacional, al menos un mes antes del inicio del viaje para poder garantizar una adecuada protección. En ocasiones, la recomendación de la vacunación podrá hacerse en el centro de atención primaria. Además, se darán una serie de consejos sobre medidas higiénicas, profilaxis antipalúdica y otras recomendaciones a tener en cuenta durante el viaje (alimentación, protección solar, baños, animales). Las vacunas que deben administrarse al adolescente sano dependerán del país de destino y de la duración y las características o el tipo de viaje.
Existen tres vacunas obligatorias de acuerdo con el Reglamento Sanitario Internacional: la antiamarílica, la antimeningocócica y la antipoliomielítica. La primera la exigen las autoridades de zonas endémicas y epidémicas y las de algunos países cuando se proceda de una zona donde la vacunación es obligatoria. La vacunación antimeningocócica conjugada ACWY, es obligatoria para los peregrinos a La Meca (Arabia Saudí) y la exigen, al igual que la antimeningocócica frente al serogrupo B, las autoridades de algunos países (los Estados Unidos, Canadá y el Reino Unido) a los estudiantes extranjeros, especialmente si se alojan en residencias universitarias. La vacuna antipoliomielítica es obligatoria para viajar a determinados países que señala la OMS, por ser endémicos o por haber reaparecido algún caso de poliomielitis después de haber sido eliminada, o la pueden exigir países libres de poliomielitis a los viajeros que procedan de países endémicos o en los que se haya producido un brote recientemente.
La consulta del viajero debe incluir en primer lugar la actualización del calendario de vacunaciones sistemáticas del adolescente si es preciso, y después se considerarán las vacunas relacionadas con los países que se visiten durante el viaje
La consulta del viajero debe incluir en primer lugar la actualización del calendario de vacunaciones sistemáticas del adolescente si es preciso, y después se considerarán las vacunas relacionadas con los países que se visiten durante el viaje, que pueden ser las siguientes:
- Vacuna frente a la fiebre amarilla: debe administrarse una dosis, un mínimo de 10 días antes del viaje y ya no es necesaria la revacunación cada 10 años. Se registra en el certificado internacional de vacunación con validez para toda la vida.
- Vacunas antimeningocócicas: la pauta de la vacuna tetravalente ACWY es de una dosis, y la de la vacuna frente al serogrupo B es de dos dosis, con un intervalo mínimo de 1 mes con Bexsero® o de 6 meses con Trumenba®.
- Vacuna antipoliomielítica: se administrará una dosis de vacuna inactivada parenteral si hace más de 10 años que el adolescente recibió la última dosis, o más de 1 año para determinados países de alto riesgo (consultar la página web de la OMS, donde está actualizada esta información).
- Vacuna antihepatitis A: primovacunación con una dosis y luego una dosis de recuerdo a los 6-12 meses. Según el preparado comercial, la presentación pediátrica se utiliza hasta los 17 o los 18 años (Vaqta® 25/50 U y Havrix® 720/1440 U ELISA, respectivamente). Hay que recordar que Cataluña, Ceuta y Melilla la tienen incorporada en su calendario de vacunaciones sistemáticas en el segundo año de vida.
- Vacuna frente a la fiebre tifoidea: puede utilizarse la forma oral (una cápsula a días alternos, en total tres cápsulas; revacunación cada 3-5 años si existe indicación) o la inactivada parenteral (dosis única; revacunación, si existe indicación, cada 3 años).
- Vacuna antirrábica: la profilaxis preexposición puede hacerse únicamente con dos dosis, a los 0 y 7 días.
- Vacuna frente a la encefalitis japonesa: dos dosis los días 0 y 7 (hasta hace poco era a los 0 y 28 días).
- Vacuna frente a la encefalitis centroeuropea: en el viajero se utiliza una pauta acelerada consistente en una primera dosis el día 0, la segunda a los 7 días y la tercera a los 21 días.
- Vacuna anticolérica: dos dosis por vía oral separadas por un intervalo de 1 semana.
- Vacuna antigripal: considerando el calendario «de máximos» propuesto (Tabla I), se administra una dosis de vacuna inactivada parenteral tetravalente.
Conclusiones
La vacunación del adolescente forma parte de las estrategias preventivas incluidas en el plan de salud de este periodo de la vida
La vacunación del adolescente forma parte de las estrategias preventivas incluidas en el plan de salud de este periodo de la vida. Al comienzo de la adolescencia (10 años), el pediatra debe incluir en la visita de control, además de las exploraciones y las pruebas de cribado correspondientes a la edad, consejos y educación para la salud; y respecto a las inmunizaciones:
- Asegurar la vacunación frente a la hepatitis B de los no vacunados previamente; la vacunación triple vírica de los no vacunados con dos dosis; la vacunación antimeningocócica ACWY de los no inmunizados; y la vacunación de la varicela a los susceptibles, es decir, a los no vacunados o que solo han recibido una dosis, o que no han padecido la enfermedad.
- Iniciar de forma precoz, a los 11 años de edad, la vacunación frente al VPH con vacuna nonavalente de chicos y chicas, y hacer una vacunación de rescate de todos los adolescentes mayores de esta edad no vacunados.
- Recomendar el calendario «de máximos», es decir, el que ofrece la máxima protección con las vacunas disponibles: una sexta dosis de vacuna frente a la tosferina con la vacuna Tdpa en lugar de la Td, hepatitis A, vacunas antimeningocócicas tetravalente ACWY y B, vacunación universal frente al VPH (incluyendo por tanto a los varones) y vacunación antigripal tetravalente anual. En el momento actual hay que incluir la vacuna frente al SARS-CoV-2 a los 12 años, con rescate durante toda la adolescencia.
- Registrar en un carnet las vacunas administradas, que el adolescente llevará siempre consigo y que pondrá en conocimiento del médico de familia cuando este se haga cargo de su asistencia.
Tablas y figuras
Tabla I. Calendario «de máximos» de vacunaciones del adolescente (2021)
|
|
Vacunaciones de recuperación:
|
Tdpa: tétanos, difteria con toxoide tipo adulto, tosferina con componentes acelulares de carga antigénica reducida; existe la vacuna Tdpa3-VPI (vacuna de la poliomielitis inactivada) por si se requiriese administrar una dosis antipoliomielítica de recuerdo; VPH: virus del papiloma humano.
* El 28 de mayo la EMA autorizó la vacuna de Pfizer-BioNTech para el grupo de 12 a 15 años de edad. La vacuna de Moderna está pendiente de autorización para la población de 12 a 17 años.
Bibliografía
- Álvarez García FJ, Cilleruelo Ortega MJ, Álvarez Aldeán J, Garcés Sánchez M, García Sánchez N, Garrote Llanos E, et al. Calendario de vacunaciones de la Asociación Española de Pediatría: recomendaciones 2021. An Pediatr (Barc). 2021;94:e1-53.e10.
- Booy R, Gentile A, Nissen M, Whelan J, Abitbol V. Recent changes in the epidemiology of Neisseria meningitidis serogroup W across the world, current vaccination policy choices and possible future strategies. Hum Vaccin Immunother. 2019;5:470-80.
- Comisión de salud pública: acuerdo alcanzado en relación a la vacunación frente a la enfermedad meningocócica invasiva. (Consultado el 19 de marzo de 2019.) Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/Acuerdo_CSP_Vacunacion_frente_meningitis.pdf.
- Comisión de salud pública: preguntas y respuestas sobre la vacunación frente a la meningitis. (Consultado el 19 de marzo de 2019.) Disponible en: http://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/docs/Preguntas_respuestas_Vacunacion_frente_meningitis.pdf.
- Comité Asesor de Vacunas de la Asociación Española de Pediatría. Vacunación frente a la Covid de niños y adolescentes. (Consultado el 18 de abril de 2021). Disponible en: https://vacunasaep.org/profesionales/noticias/covid-19-vacunacion-de-ninos-y-adolescentes.
- European Centre for Disease Prevention and Control. Expert opinion on the introduction of the meningococcal B (4CMenB) vaccine in the EU/EEA. Stockholm: ECDC; 2017.
- Folaranmi T, Rubin L, Martin SW, Patel M, MacNeil JR. Use of serogroup B meningococcal vaccines in persons aged ≥10 years at increased risk for serogroup B meningococcal disease: recommendations of the Advisory Committee on Immunization Practices, 2015. MMWR Morb Mortal Wkly Rep. 2015;64:608-12.
- Knol MJ, Hahné SJM, Lucidarme J, Campbell H, de Melker HE, Gray SJ, et al. Temporal associations between national outbreaks of meningococcal serogroup W and C disease in The Netherlands and England: an observational cohort study. Lancet Public Health. 2017;2:e473-82.
- Limia Sánchez A, Olmedo Lucerón C et al. 2º Estudio de Seroprevalencia en España, 2017-2018. Rev Esp Salud Pública. 2021; 95: 18 de marzo e202103059es.
- MacNeil JR, Rubin L, Folaranmi T, Ortega-Sánchez IR, Patel M, Martin SW. Use of serogroup B meningococcal vaccines in adolescents and young adults: recommendations of the Advisory Committee on Immunization Practices, 2015. MMWR Morb Mortal Wkly Rep. 2015;64:1171-6.
- MacNeil JR, Rubin L, McNamara L, Briere EC, Clark TA, Cohn AC. Use of MenACWY-CRM vaccine in children aged 2 through 23 months at increased risk for meningococcal disease: recommendations of the Advisory Committee on Immunization Practices, 2013. MMWR Morb Mortal Wkly Rep. 2014;63:527-30.
- Ministerio de Sanidad. Coberturas de vacunación. Datos estadísticos. (Consultado el 18 de abril de 2021) Disponible en: https://www.mscbs.gob.es/profesionales/saludPublica/prevPromocion/vacunaciones/calendario-y-coberturas/coberturas/home.htm.
- Moraga-Llop FA. Diez años de vacunación frente al virus del papiloma humano. De la dermatología a la oncología a través de la infectología. An Pediatr (Barc). 2018;88:289.e1-6.
- Moraga-Llop FA. Vacunas en la adolescencia. Adolescere. 2018;VI(2):6-14.
- Moraga-Llop FA, Marès Bermúdez J. Estrategias dinámicas de prevención en la enfermedad meningocócica invasiva. Pediatr Integral. 2019;XXIII(2):61-4.
- Moraga-Llop FA. Novedades en vacunología 2019-2020. En: Campins Martí M, Moraga Llop FA, editores. Vacunas 2020. Madrid: Undergraf; 2020. p. 151-73.
- Moraga-Llop FA. Vacunación frente a la COVID-19 en los adolescentes. Una realidad. Vacunas. 2021. https://doi.org/10.1016/j.vacun.2021.05.003.
- Ortega Páez E, Esparza Olcina MJ. La edad óptima para vacunar con la vacuna conjugada antimeningocócica ACWY es entre los 12 y los 15 años. Evid Pediatr. 2017;13:50.
- Patton ME, Stephens D, Moore K, MacNeil JR. Updated recommendations for use of MenB-FHbp serogroup B meningococcal vaccine — Advisory Committee on Immunization Practices, 2016. MMWR Morb Mortal Wkly Rep. 2017;66:509-13.
- Schneyer RJ, Yang C, Bocchini Jr JA. Immunizing adolescents: a selected review of recent literature and US recommendations. Curr Opin Pediatr. 2015;27:405-17.