Hiperandrogenismo, ¿Qué hacer?
Hiperandrogenismo, ¿Qué hacer?
M.B. Roldán Martín(*), M. Echeverría Fernández(**).
(*)Unidad de Endocrinología y Diabetes Pediátrica. Servicio de Pediatría. Hospital Universitario Ramón y Cajal. Universidad de Alcalá. Madrid.(**) Servicio de Pediatría. Hospital Universitario Rey Juan Carlos. Móstoles, Madrid. Universidad Rey Juan Carlos. Móstoles, Madrid.
Adolescere 2015 III (2): 118-126
Resumen
|
El hiperandrogenismo es una situación de producción y/o acción androgénica excesiva que se presenta en mujeres adolescentes y adultas en forma de hirsutismo, acné, alopecia androgénica e irregularidades menstruales, dando lugar a un síndrome de ovario poliquístico (SOP) (1,2). En las adolescentes, el hiperandrogenismo es generalmente secundario a un exceso de la síntesis de andrógenos en el ovario y/o la suprarrenal y solo en una minoría de los casos existe un trastorno específico responsable del hiperandrogenismo (hiperplasia suprarrenal congénita, tumores, síndrome de Cushing, hipersecreción de hormona de crecimiento, fármacos u otros). Palabras clave: Hiperandrogenismo; Adolescentes; Síndrome de ovario poliquístico. |
Abstract
|
Hyperandrogenism is an excessive androgenic production and / or action that manifests in adolescent and adult women as hirsutism, acne, androgenic alopecia and menstrual irregularities, resulting in polycystic ovary syndrome (PCOS). In adolescent females, hyperandrogenism is usually secondary to excessive androgen synthesis in the ovary and/or adrenal and only in a minority of cases there is a specific underlying disorder (congenital adrenal hyperplasia, tumors, Cushing syndrome, hypersecretion of growth hormone, drugs, or other causes). Key words: Hyperandrogenism; Adolescents; Polycystic ovary syndrome. |
Caso clínico
Enfermedad actual: Adolescente de 14 años remitida por su pediatra de atención primaria por hirsutismo. En seguimiento en consulta desde los 9 años de edad por pubertad adelantada. Refería mucho vello “desde siempre”. Tuvo la menarquia a los 10 años y 6 meses y desde entonces las reglas son irregulares. Presenta acné frontal desde los 12 años. No toma ninguna medicación.
Antecedentes familiares: Madre, talla 150,7 cm, hipertricosis. Padre, talla 162 cm, diagnosticado de diabetes tipo 1 a los 32 años. Antecedentes de hipertricosis en la familia paterna. No constan diabetes tipo 2, HTA, hipercolesterolemia, infartos agudos de miocardio o accidentes cerebrovasculares.
Antecedentes personales: Embarazo controlado y normal. Cesárea. EG: 39+6 semanas. PRN: 2.980 g (-0,8 DE). LRN: 49 cm (-0,5 DE).
Exploración Física: Peso: 58,2 kg. Talla: 161,5 cm (+1,0 DE). IMC: 22,3% (+0,7 DE). Perímetro de cintura: 71 cm. TA: 106/56. Buen estado general. Ferriman-Gallwey: 13. ACP: normal. Abdomen: normal. Cuello libre. Estadío de Tanner V.
Estudios complementarios: Analítica (extracción realizada en 3º día del ciclo menstrual):
— Hemograma y Bioquímica: normal. Glucemia: 86 mg/dl. Creatinina: 0.6 mg/dl. GOT/GPT: 17/13 UI/L. Lipidograma: Colesterol total: 139 mg/dl. TG: 50 mg/dl. Colesterol HDL: 64 mg/dl. Colesterol LDL: 65 mg/dl
— Insulina: 11,2 mUI/L
— Índice HOMA: 2,3 (N<3,8)
— Estudio hormonal basal: TSH: 1,07 µU/ml (0,5-4,5). T4L: 0,7 ng/dl (0,4-1,4). PRL: 13 ng/ml (2-20). Testosterona: 0,4 ng/ml (0,1-0,8 ng/ml). SHBG: 32,5 nmol/l (20-140 nmol/l). FAI: 4,3 (N<5). Androstendiona: 3,1 ng/ml (0,5-4,7 ng/ml). DHEA-S: 177 µg/dl (120-360 µg/dl). 17-OHP: 0,7 ng/ml (0,1-1,5 ng/ml)
Estudios de imagen:
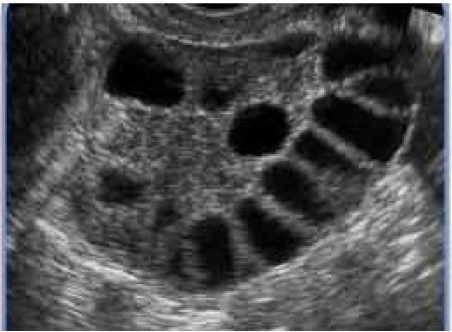
Ecografía abdominal (realizada en el 4º día del ciclo menstrual): Útero de 7,6 cm de ecoestructura normal. Ovario derecho de 13 cc y ovario izquierdo de 12 cc con múltiples quistes (>12) entre 2 y 5 mm de diámetro.
Diagnóstico
Síndrome de ovario poliquístico (Hiperandrogenismo clínico + Oligomenorrea + Ovarios poliquísticos).
Tratamiento
1. Recomendaciones sobre el estilo de vida 2. ACO (Etinilestradiol 0,035 mg + acetato de ciproterona 2 mg) 3. Medidas cosméticas.
Sindrome de ovario poliquístico
El SOP es un trastorno de presentación heterogénea, cuyas manifestaciones pueden ser diferentes entre pacientes. Es uno de los motivos de consulta más frecuente de las adolescentes en las consultas de endocrinología y causa potencial de problemas, no solo físicos, sino también psicológicos. Por ello es importante que los médicos de atención primaria conozcan el SOP, que presten atención a las quejas de las adolescentes con SOP y que se impliquen en la prevención de las posibles asociaciones del síndrome en la etapa adulta. No obstante, no existen guías clínicas para el diagnóstico y el tratamiento del SOP en las adolescentes.
Es uno de los motivos de consulta mas frecuente en las adolescentes. Los pediatras son los primeros en observar las manifestaciones clínicas (adrenarquia exagerada).
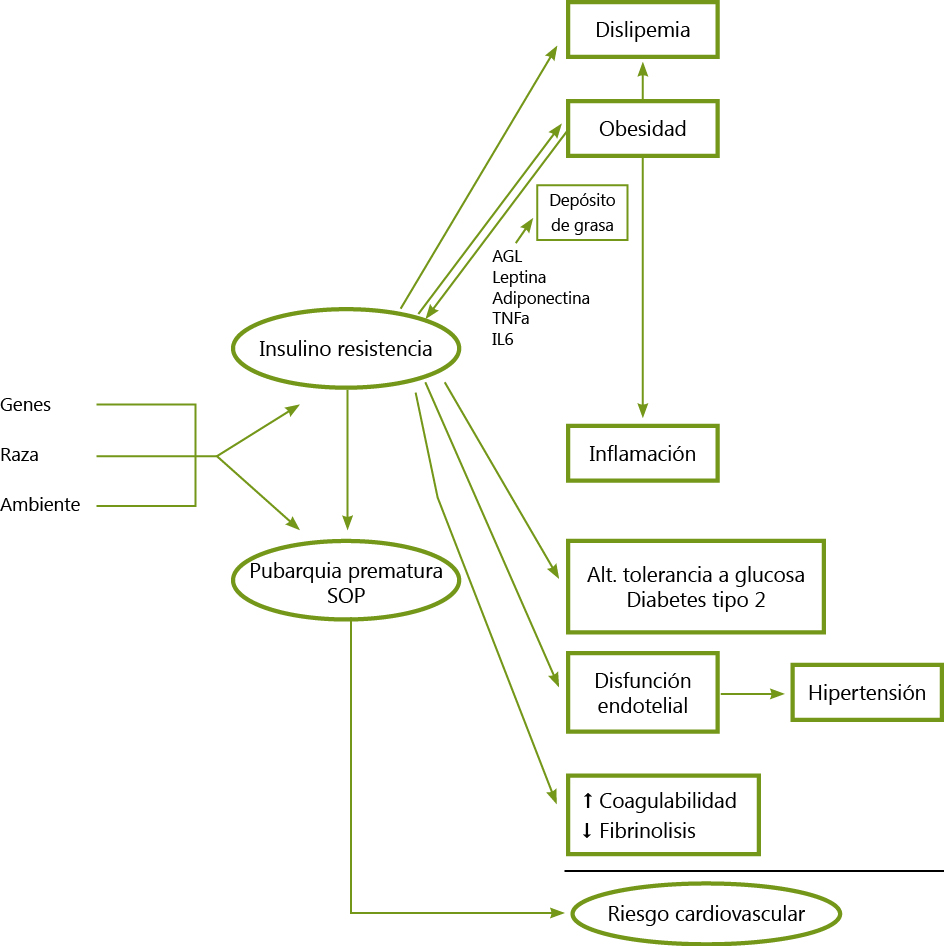
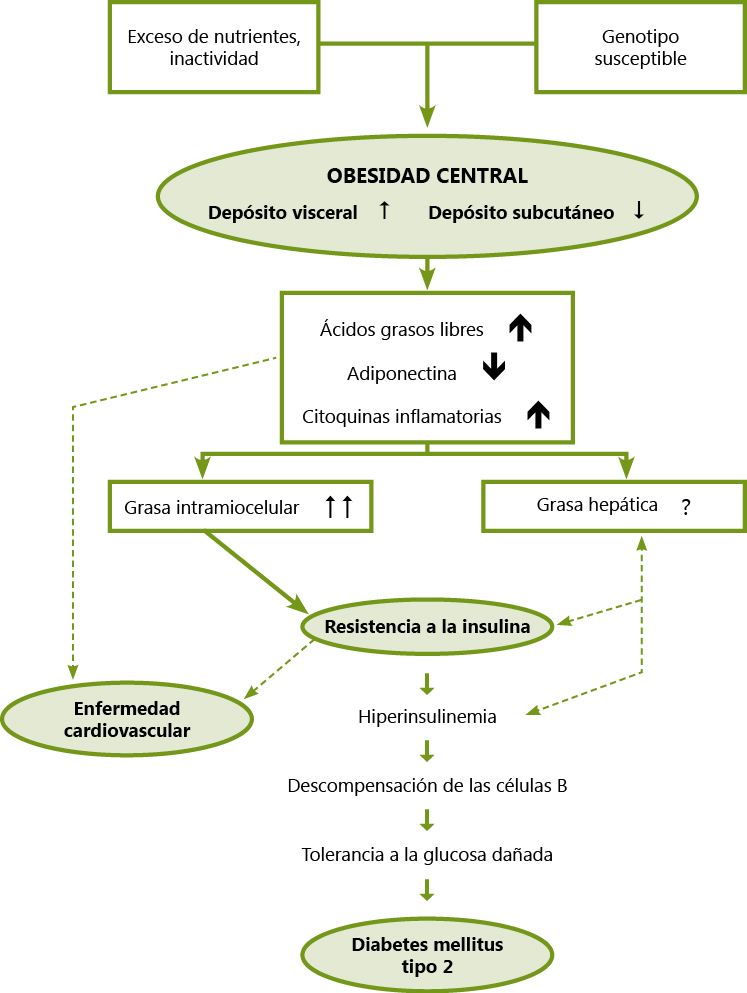
Etiología. La etiología del SOP es multifactorial y se implican factores genéticos, raciales y ambientales. La patogenia del síndrome está en discusión aunque se piensa que es el resultado de un círculo vicioso entre hiperandrogenismo e hiperinsulinismo. (Figura 1).
Clínica. Las manifestaciones clínicas del SOP son el hirsutismo, las irregularidades menstruales (oligomenorrea que persiste más de dos años después de la menarquia, amenorrea o hemorragia uterina disfuncional), acné, alopecia, y durante la etapa reproductiva, la infertilidad. La acantosis nigricans puede aparecer como un signo de insulinorresistencia. En algunos casos, los pediatras son los primeros en observar las manifestaciones del SOP en forma de una adrenarquia exagerada que evoluciona en la adolescencia hacia algunas de las manifestaciones del síndrome.
Prevalencia. Se desconoce cuál es la prevalencia del SOP en las adolescentes, aunque recientemente se ha publicado una cifra del 4,3% (en población adulta, de un 5 a un 10% -en España 6,5%-) (3). Aproximadamente el 55-73% de las pacientes adolescentes con SOP asocian sobrepeso u obesidad y es motivo de preocupación que la incidencia del síndrome está en aumento (asociado a obesidad de predominio central) y que la insulinorresistencia, que es frecuente en pacientes obesas con un aumento del perímetro cintura y de la grasa visceral, puede empeorar las manifestaciones metabólicas y reproductivas del síndrome.
Con frecuencia, las pacientes con SOP no son diagnosticadas aunque hayan consultado al dermatólogo por hirsutismo o acné o realicen seguimiento por su médico por dislipemia, obesidad o alteración de la tolerancia a la glucosa o porque refieran su preocupación por las manifestaciones del síndrome al psicólogo en forma de ansiedad o depresión.
Aproximadamente el 50% de las adolescentes con SOP asocian sobrepeso u obesidad.
Diagnóstico. El diagnóstico del SOP es de exclusión tras descartar otras patologías que suponen un exceso androgénico.
Las irregularidades menstruales se definen como la presencia de más de 6 ciclos menstruales al año con una duración superior a 35 días (oligomenorrea) o la ausencia de sangrado vaginal durante 3 meses consecutivos durante el último año (amenorrea).
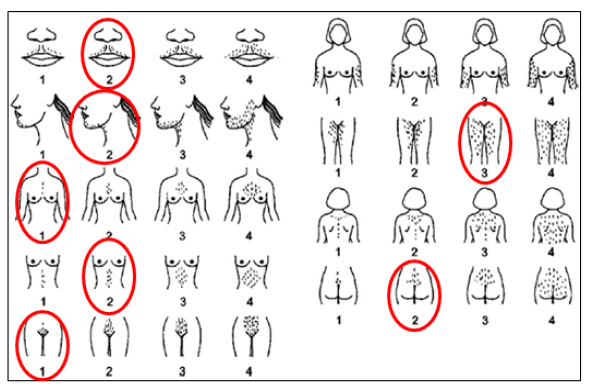
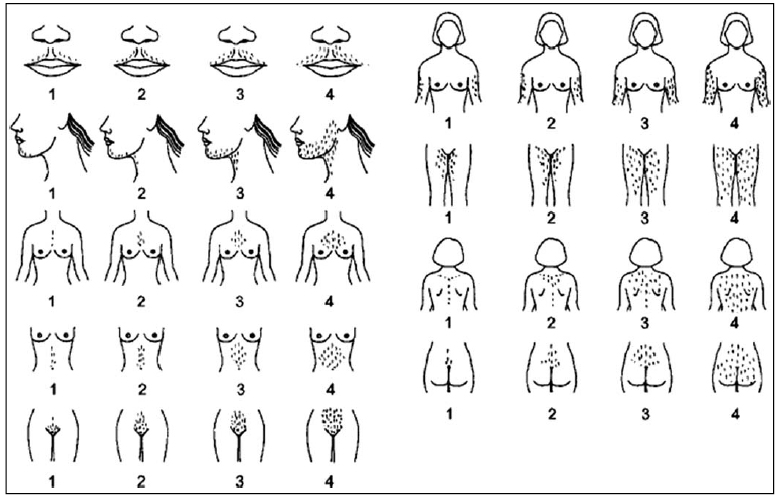
El hirsutismo es el exceso de crecimiento del pelo de carácter terminal en la mujer con una distribución en zonas típicamente masculinas. Para su valoración objetiva se utiliza fundamentalmente la escala de Ferriman-Gallwey modificada en mujeres de raza caucásica y una puntuación ≥ 8 es considerada diagnóstica (4). (Figura 2). Es necesario hacer el diagnóstico diferencial del hirsutismo con la hipertricosis, que no se debe al exceso de andrógenos sino que depende de factores raciales y familiares, o es secundario a trastornos metabólicos (tiroideos, anorexia nerviosa) o al uso continuado de determinados fármacos (glucocorticoides, ACTH, esteroides anabolizantes, levonorgestrel y progestágenos sintéticos, fenitoína, minoxidil, diazóxido, ciclosporina…). En algunos casos, los trastornos menstruales no asociados a hirsutismo pueden ser la primera manifestación de una enfermedad crónica, de trastornos del comportamiento alimentario o ser consecuencia de la práctica de un ejercicio intenso como el atletismo o la danza en los que el control de peso es importante.
La hiperandrogenemia se define como un aumento de las concentraciones de ∆4-androstenediona, DHEAS, testosterona o testosterona libre para la edad cronológica o el estadio de desarrollo puberal. Existen casos de hiperandrogenismo bioquímico sin traducción clínica (hiperandrogenismo “críptico”). El diagnóstico diferencial del SOP con una forma tardía de hiperplasia suprarrenal congénita por déficit de 21-hidroxilasa se hará mediante el test de estímulo con ACTH, que está indicado cuando los niveles basales de 17-hidroxiprogesterona sean superiores a 2 ng/mL (6 nmol/L). Las respuestas de 17-hidroxiprogesterona al test de ACTH >10 ng/mL (30 nmol/L) sugiere el diagnóstico de HSC cuya confirmación se realizará mediante el oportuno estudio molecular.
No existen criterios universalmente aceptados para el diagnóstico del SOP en el grupo de las adolescentes y resulta difícil realizar el diagnóstico del síndrome en este grupo de edad (5, 6). Las niñas pueden presentar acné, un aumento del crecimiento del vello terminal e irregularidades menstruales durante el primer año después de la menarquia y, a veces, los hallazgos de SOP son transitorios y relacionados con la fisiología de la pubertad. Los ciclos menstruales son con frecuencia anovulatorios en los primeros años después de la menarquia (85% en el primer año a 59% en el tercer año). Un 14 % de las adolescentes tienen irregularidades menstruales (< 22 o > 41 días en dos ciclos durante el último año) y 6% presenta oligomenorrea. El acné está presente en el 70% de las adolescentes -y no relacionado con otras manifestaciones del SOP- y el hirsutismo es leve por el corto tiempo de evolución de las pacientes. Además, no existen datos normalizados para definir los valores de los andrógenos durante la adolescencia. Por último, el volumen ovárico es mayor en las adolescentes y el 30% tienen ovarios > 10 cc, observándose ovarios poliquísticos en un 10% de las adolescentes con reglas regulares, 28% en las que tienen reglas irregulares y 45% en las que presentan oligomenorrea.
El panel de expertos de la AE-PCOS (Androgen Excess and Polycystic Ovary Syndrome Society) ha publicado un consenso que establece que el criterio central para el diagnóstico del síndrome es el hiperandrogenismo clínico y/o bioquímico y la disfunción ovárica (oligo-anovulación dos años después de la menarquia y/o ovarios poliquísticos) y, probablemente, estos son los criterios que deberíamos utilizar en las adolescentes (7). El diagnóstico ecográfico de los ovarios poliquísticos es difícil en las adolescentes, especialmente en pacientes obesas, ya que la calidad de la imagen no es buena al no utilizarse la vía transvaginal en la mayoría de los casos; de ahí que posiblemente el aumento del volumen ovárico por encima de los 10 cc sea el mejor marcador en las jóvenes (aunque el criterio ecográfico no debería ser utilizado como fundamental para el diagnóstico del SOP en este grupo de edad) (8). En 2013 la Sociedad de Endocrinología de EE.UU. advirtió sobre la necesidad de ser cautos en el diagnóstico del SOP en las niñas adolescentes por las posibles implicaciones futuras sobre su salud ginecológica, metabólica y mental (9).
El criterio central para el diagnóstico de SOP es el hiperandrogenismo clínico y/o bioquímico y la disfunción ovárica.
En cualquier caso, se deberá realizar el seguimiento a largo plazo de la adolescente con síntomas sugerentes de SOP que inicialmente no reúna los criterios diagnósticos del síndrome.
Otras manifestaciones del SOP
Las mujeres con SOP presentan un riesgo aumentado de desarrollar obesidad, alteración de la tolerancia a la glucosa, diabetes, dislipidemia, síndrome metabólico, infertilidad, hiperplasia endometrial, cáncer de endometrio, cáncer de ovario, ansiedad y cambios en el estado de ánimo.
La prevalencia de alteración de la tolerancia a la glucosa en adolescentes con SOP obesas es de un 27%. Además, las adolescentes con SOP presentan un aumento de los niveles de colesterol total y de la fracción LDL del colesterol, alteraciones en la secreción de las adipocitoquinas y de los marcadores inflamatorios, y modificaciones en la tensión arterial. Un 11,8% de las adolescentes con SOP presentan un síndrome metabólico y, aproximadamente el 35% de las adolescentes con SOP y sobrepeso u obesidad lo asocian (10).
Tratamiento
El tratamiento de las adolescentes con SOP debe contemplar objetivos a corto y largo plazo, incluyendo la mejora de su imagen corporal y la autoestima (11). La paciente debe conocer la posible asociación del síndrome con obesidad e insulinorresistencia, siendo nuestro objetivo prevenir y evitar el posible desarrollo del riesgo cardiovascular asociado al síndrome metabólico.
Resulta fundamental modificar el estilo de vida de las pacientes, insistiendo en cambios en sus hábitos de alimentación e incremento del ejercicio. La pérdida de un 5-10% de peso en las pacientes adultas con SOP y sobrepeso se traduce en muchos casos en la recuperación de la regla y la aparición de ciclos ovulatorios.
El tratamiento de las adolescentes con SOP debe contemplar objetivos a corto y largo plazo, incluyendo la mejora de su imagen corporal y la autoestima.
El tratamiento farmacológico de elección para el control de los síntomas y signos del SOP son los anticonceptivos orales, especialmente cuando las pacientes solo presentan irregularidades menstruales. Cuando el motivo de consulta principal sea el hirsutismo o el acné, además de indicar la aplicación de medidas cosméticas, utilizaremos anticonceptivos que contengan un antiandrógeno (en España, acetato de ciproterona). El efecto de los anticonceptivos orales sobre las reglas y el acné es evidente en 1-3 meses, sobre el hirsutismo a los a los 6-9 meses. Para destruir los folículos afectados es necesario utilizar electrolisis o láser. El tratamiento debería ser continuado durante al menos 2 años, aunque muchas mujeres requieren tratamiento de forma indefinida. No existen criterios aceptados para el uso de metformina, aunque este fármaco mejora la sensibilidad a la insulina en pacientes con SOP e hiperinsulinemia u obesidad. La metformina puede resultar indicada en pacientes con alteración de la tolerancia a la glucosa, acantosis nigricans o con antecedentes familiares de diabetes tipo 2, aunque no existen estudios a largo plazo que demuestren los resultados y no es eficaz en el tratamiento del hirsutismo (11).
El tratamiento se realiza con anticonceptivos hormonales orales con antiandrógenos (acetato de ciproterona) durante al menos dos años.
Seguimiento de las adolescentes con SOP
Es fundamental motivar a las adolescentes con SOP y reforzar la importancia de la prevención de los factores de riesgo asociados al síndrome metabólico.
Se aconseja revisar periódicamente el peso, tensión arterial, niveles de glucosa y lípidos y realizar una sobrecarga oral de glucosa cuando las pacientes presenten anovulación e hiperandrogenismo, acantosis nigricans, obesidad (IMC > 30 kg/m2) o historia familiar de diabetes tipo 2 (5). La frecuencia con la que habrá que realizar el seguimiento depende del riesgo cardiovascular en cada caso (al menos anual en las pacientes con alto riesgo y cada 3-5 años en pacientes con bajo riesgo). Es importante desaconsejar que adquieran el hábito de fumar.
Impacto del SOP en las adolescentes
La adolescencia es un periodo de desarrollo biológico, psicológico y social. El SOP puede afectar a la percepción de la imagen corporal y la identidad sexual de la adolescente y favorecer que se aísle socialmente o que desarrolle problemas en su relación con otros adolescentes o en sus relaciones íntimas o que su autoestima caiga y empeore su rendimiento escolar.
Desde el principio, es fundamental reforzar la necesidad de adoptar un estilo de vida saludable para la prevención de factores de riesgo cardiovascular y evitar la progresión del síndrome.
Muchas veces las jóvenes con SOP se quejan de que los médicos se centran en los problemas médicos y olvidan las cuestiones psicológicas. Por ello, es importante que como profesionales de la salud identifiquemos a las adolescentes con un posible SOP y realicemos su seguimiento, prestemos atención a la aparición de comportamientos de riesgo y las derivemos al endocrinólogo pediatra o de adultos para mejorar la información sobre el trastorno que presentan y ofrecerle posibles tratamientos. Desde el principio, es fundamental reforzar la necesidad de adoptar un estilo de vida saludable para la prevención de factores de riesgo cardiovascular y evitar la progresión del síndrome.
Tablas y figuras
Figura 1. Patogenia del síndrome de ovario poliquístico. Insulinorresistencia y tejido adiposo.
TNFalfa = factor de necrosis tumoral alfa. IL= interleukina
Figura 2. Escala de Ferriman-Gallwey modificada para la valoración del hirsutismo.
Tomada de Yildiz et al (4)
Bibliografía
1. Escobar-Morreale HF, Carmina E, Dewailly D, Gambineri A, Kelestimur F, Moghetti P, et al. Epidemiology, diagnosis and management of hirsutism: a consensus statement by the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2012; 18: 146-70.
2. Diamanti-Kandarakis E. PCOS in adolescents. Best Pract Res Clin Obstet Gynaecol. 2010; 24:173-83.
3. Gambineri A, Fanelli F, Prontera O, Repaci A, Di Damazi G, Zanotti L. Prevalence of hyperandrogenic states in late adolescent and young women: epidemiological survey on italian high-school students. J Clin Endocrinol Metab. 2013; 98: 1641-50.
4. Yildiz BO, Bolour S, Woods K, Moore A, Azziz R. Visually scoring hirsutism. Hum Reprod Update. 2010; 16: 51-64.
5. Hardy TS, Norman RJ. Diagnosis of adolescent polycystic ovary syndrome. Steroids. 2013; 78: 751-4.
6. Mani H, Potdar N, Gleeson H. How to manage an adolescent girl presenting with features of polycystic ovary syndrome (PCOS); an exemplar for adolescent health care in endocrinology. Clin Endocrinol (Oxf). 2014; 81: 652-6.
7. Azziz R, Carmina E, Dewailly D, Diamanti-Kandarakis E, Escobar-Morreale HF, Futterweit W, et al; Androgen Excess Society. Position statement: criteria for defining polycystic ovary syndrome as a predominantly hyperandrogenic syndrome: an Androgen Excess Society guideline. J Clin Endocrinol Metab. 2006; 91: 4237-45.
8. Dewailly D, Lujan ME, Carmina E, Cedars MI, Laven J, Norman RJ, Escobar-Morreale HF. Definition and significance of polycystic ovarian morphology: a task force report from the Androgen Excess and Polycystic Ovary Syndrome Society. Hum Reprod Update. 2014; 20: 334-52.
9. Legro RS, Arslanian SA, Ehrmann DA, Hoeger KM, Murad MH, et al. Diagnosis and treatment of polycystic ovary syndrome: an Endocrine Society clinical practice guideline. J Clin Endocrinol Metab. 2013; 98: 4565-92.
10. Hart R, Doherty DA, Mori T, Huang RC, Norman RJ, Franks S, et al. Extent of metabolic risk in adolescent girls with features of polycystic ovary syndrome. Fertil Steril. 2011; 95: 2347-53.
11. Legro RS. Impact of metformin, oral contraceptives, and lifestyle modification on polycystic ovary syndrome in obese adolescent women: do we need a new drug?. J Clin Endocrinol Metab. 2008; 93: 4218-20.
12. Palomba S, Materazzo C, Falbo A, Orio F, La Sala GB, Sultan C. Metformin, oral contraceptives or both to manage oligo-amenorrhea in adolescents with polycystic ovary syndrome?. A clinical review. Gynecol Endocrinol. 2014; 30: 335.