Complicaciones crónicas de los trastornos del comportamiento alimentario
Complicaciones crónicas de los trastornos del comportamiento alimentario
M.T. Muñoz Calvo.
Unidad de Endocrinología. Servicio de Pediatría. Hospital Ruber Internacional. Madrid..
Adolescere 2019; VII (2): 30-35
Resumen
|
La anorexia nerviosa es una enfermedad psiquiátrica, de comienzo en la infancia o en la adolescencia, que cursa con escasa ingesta y pérdida de peso progresiva que genera malnutrición más o menos severa. Los criterios actuales se regulan por la Academia Americana de Pediatría (DSM-5). La etiología es multifactorial (factores genéticos, biológicos, psicológicos y culturales). Las complicaciones médicas son multiorgánicas: amenorrea, hipogonadismo hipogonadotropo, hipotiroidismo, alteraciones cardiovasculares, gastrointestinales, neurológicas, hematológicas, vómitos, osteopenia/osteoporosis y riesgo de fracturas óseas. La pérdida de masa ósea es frecuente, desarrollándose preferentemente en el hueso trabecular (mujeres), y en el hueso cortical (varones). El tratamiento debe llevarse a cabo por un equipo multidisciplinario, advirtiendo al paciente y a su familia de la importancia de la enfermedad. El objetivo principal del tratamiento es la recuperación de peso y la normalización de los ciclos menstruales. El tratamiento con estrógenos y gestágenos, estaría indicado cuando la amenorrea es de al menos un año de duración, siendo los estrógenos transdérmicos los que mantendrían o incrementarían la masa ósea (por supresión escasa o nula sobre IGF-I). El tratamiento psiquiátrico es prioritario, radicando en la intervención sobre la psicopatología específica. Palabras clave: Amenorrea; Masa ósea; Malnutrición; Osteopenia; Osteoporosis |
Abstract
|
Anorexia nervosa is a psychiatric disorder with childhood or adolescence onset, characterized by low intake and progressive weight loss that generates more or less severe malnutrition. The current criteria are regulated by the American Academy of Pediatrics (DSM-5). Etiology is multifactorial (genetic, biological, psychological and cultural factors). Medical complications are multiorganic: amenorrhea, hypogonadotropic hypogonadism, hypothyroidism, cardiovascular, gastrointestinal, neurological, hematological, vomiting, osteopenia / osteoporosis and risk of bone fractures. Loss of bone mass is frequent, involving trabecular bone (women), and cortical bone (males), preferentially. Treatment must be carried out by a multidisciplinary team, warning the patient and family about the importance of the disease. The main objective of the treatment is weight recovery and normalization of menstrual cycles. Treatment with estrogen and progestogen would be indicated when amenorrhea is at least over one year, with transdermal estrogens as these maintain or increase bone mass (due to little or no suppression of IGF-I). Psychiatric treatment is a priority, based on the intervention on specific psychopathology. Key words: Amenorrhea; Bone mass; Malnutrition; Osteopenia; osteoporosis. |
Introducción
En los trastornos del comportamiento alimentario (TCA) se observan complicaciones multiorgánicas, que afectan al sistema cardiovascular y periférico, y a los sistemas gastrointestinal, hematológico, renal, esquelético, endocrinológico y metabólico. Estas alteraciones se encuentran relacionadas no sólo con el estado de malnutrición, sino también con la conducta de estos pacientes respecto al control de su peso.
Las alteraciones endocrinas y metabólicas descritas expresan disfunción hipotalámica, incluyendo amenorrea-oligomenorrea, retraso puberal, hipotiroidismo, hipercortisolismo, deficiencia de IGF-I, anomalías electrolíticas, hipoglucemia e hipofosfatemia.
Las manifestaciones clínicas de la AN son complejas, afectando a todos los sistemas del organismo
Las manifestaciones clínicas de la anorexia nerviosa (AN) son complejas, afectando a todos los sistemas del organismo y dependiendo ampliamente de si la forma es restrictiva o purgativa. Del 10-20% de pacientes con AN tienen tendencias bulímicas, que fundamentalmente incluyen la provocación de vómitos, el empleo de laxantes y un incremento compulsivo de la actividad física.
Complicaciones
Alteraciones cardiovasculares
Acontecen en el 80% de los pacientes, incluyendo bradicardia e hipotensión. Son debidas a disbalances del sistema nervioso autónomo. Las alteraciones electrocardiográficas pueden mostrar arritmias auriculares y ventriculares y anomalías QT. Además, se han publicado cambios en la función miocárdica con disminución en la masa tisular miocárdica, prolapso de la válvula mitral y derrame pericárdico.
Complicaciones gastrointestinales
Son también frecuentes. En efecto, en pacientes con AN puede apreciarse disminución de la motilidad gastrointestinal que genera estreñimiento. El abuso de laxantes puede conducir a un síndrome de colon catártico y a estreñimiento crónico que, en ocasiones, es refractario al tratamiento. Los casos de dilatación gástrica aguda se han descrito durante la fase de realimentación de pacientes con AN extremadamente afectadas, ya que el vaciamiento gástrico de sólidos está retrasado, con vaciamiento de líquidos también retrasado en algunos pacientes. Las alteraciones esofágicas incluyen esofagitis severa e incluso ruptura de esófago asociada con vómitos inducidos.
La dilatación gástrica aguda se observa durante la fase de realimentación en pacientes muy afectadas
Alteraciones neurológicas
Derivan de la malnutrición severa. La TAC y la RMC han demostrado la existencia de atrofia cortical y dilatación ventricular. Los pacientes malnutridos tienen mayores volúmenes de LCR y reducción de la materia blanca y grasa. En general, las anomalías en la TAC son reversibles con la recuperación nutricional tras la realimentación.
Alteraciones hematológicas
Entre ellas, cabe destacar las que siguen: anemia, leucopenia (neutropenia relativa y linfocitosis), trombocitopena y disminución de los niveles de fibrinógeno. La anemia y pancitopenia ocasionales parecen deberse a la hipoplasia de la médula ósea. La función celular inmune también puede estar alterada, incluyendo modificaciones en IgG, IgA y factores de complemento C3 y C4 y alteraciones en las subpoblaciones linfocitarias CD3, CD4 y CD57. No obstante, las infecciones son infrecuentes en estos pacientes.
Vómitos
Proceden de la pérdida de sodio, hidrógeno y potasio, causantes de alcalosis metabólica. El empleo de laxantes provoca pérdida de potasio y de bicarbonato, pudiendo resultar en acidosis metabólica.
El empleo de diuréticos puede incrementar la pérdida de sodio, potasio y calcio en la orina, dependiendo de la dosis y medicamento empleado.
El empleo de laxantes produce pérdida de potasio y bicarbonato, dando como resultado una acidosis metabólica
Alteraciones renales
Están presentes en el 7% de estos pacientes, pudiendo incluir: descenso de la filtración glomerular, incremento de urea y creatinina plasmáticas, alteraciones de electrolitos, edema y nefropatía hipokaliémica. La capacidad de concentración renal está alterada, pudiendo existir poliuria.
Hipercolesterolemia moderada
Es frecuente en la AN, con elevación de C-LDL y normalidad en C-HDL y C-VLDL. Los niveles de triglicéridos son también normales.
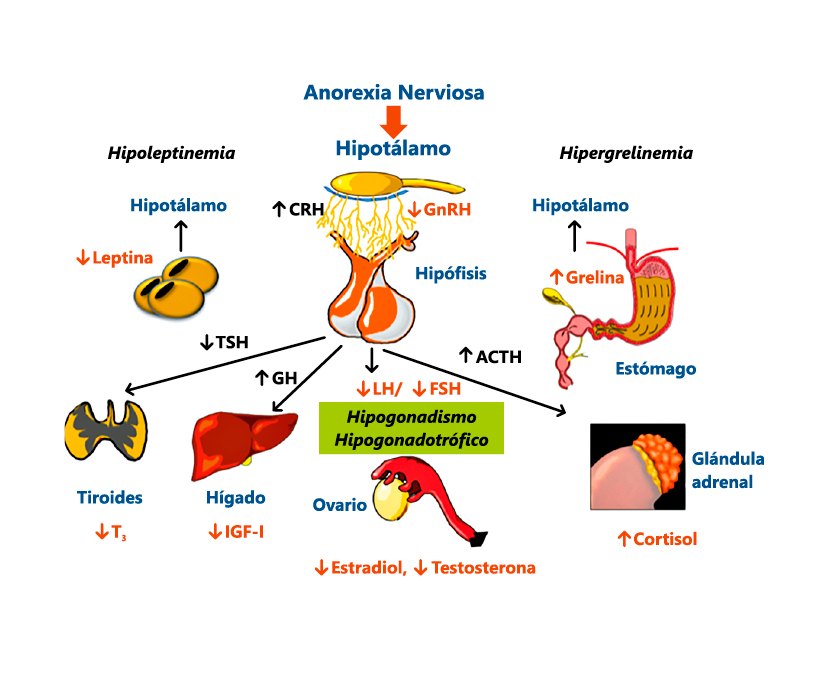
Complicaciones endocrinas (Figura 1)
Hipogonadismo hipogonadotropo
El hipogonadismo hipogonadotropo de origen hipotalámico es característico en pacientes con AN.
La causa es desconocida, aunque existen múltiples factores que pueden formar parte: la disfunción hipotalámica, la reducción del peso corporal, los esteroides sexuales, las alteraciones en los neurotransmisores y el ejercicio físico, entre otros.
Las mujeres con AN tienen niveles basales disminuidos de la hormona luteinizante (LH) y de la hormona folículoestimulante (FSH), así como niveles bajos de estradiol y testosterona, indicando una alteración de la función hipotálamo-hipófiso-ovárica. Estas alteraciones son debidas, por un lado, a una fase folicular prolongada y, por otro a una insuficiente fase luteínica. Asimismo, la secreción espontánea de LH durante un periodo de 24 horas está disminuida tanto en la frecuencia como en la amplitud de los picos secretorios. La recuperación del peso se acompaña, en general, de un incremento de los niveles de ambas gonadotrofinas.
La malnutrición puede ser responsable del retraso puberal y la reducción del crecimiento. Este fenómeno se interpreta como un mecanismo de adaptación a la reducción en nutrientes. Cuando los síntomas aparecen después de la pubertad, la amenorrea secundaria está presente. La hipoinsulinemia es común, como consecuencia de la disminución de los niveles de glucosa y de aminoácidos.
La malnutrición puede ser responsable del retraso puberal y la reducción del crecimiento
Alteraciones tiroideas
Los pacientes con AN pueden presentar hipotiroidismo, en ocasiones denominado “síndrome eutiroideo” (Figura 1). Las manifestaciones clínicas incluyen: pérdida de cabello, piel seca, hipotermia y bradicardia. Muestran niveles séricos normales-bajos de T4 y TSH, normales-bajos de T3 y elevados de T3 inversa. La ecografía demuestra que el tiroides está muy disminuido en relación a las controles. Esta atrofia glandular no es debida a los niveles bajos de TSH, pero está influenciado por los niveles del factor de crecimiento semejante a la insulina (IGF-1). Estas alteraciones se normalizan con la recuperación ponderal.
Alteraciones del eje de la hormona de crecimiento
Los estudios que han analizado la secreción espontánea de hormona de crecimiento (GH) en pacientes con AN en el momento del diagnóstico, han demostrado que estas pacientes tienen una secreción espontánea de GH heterogénea, resultado de modificaciones en la amplitud de los picos de secreción, pero no de su frecuencia. La recuperación ponderal parcial, al menos un 10% de su peso inicial, normaliza los parámetros de la secreción espontánea de GH.
Las pacientes con AN presentan una marcada reducción en los niveles séricos de IGF-I, que tienden a normalizarse tras la recuperación ponderal; no obstante, el tiempo necesario para ello, al igual que ocurre en otras formas de malnutrición, puede ser muy prolongado (Figura 1).
La coexistencia de niveles reducidos de IGF-I y normales o elevados de GH, indicaría la existencia de una resistencia a la acción de la GH en la malnutrición en general y en la AN en particular. Las anomalías de secreción de hormona de crecimiento (GH) y los bajos niveles de IGF-I contribuyen al escaso crecimiento en pacientes prepúberes y a la reducción de su talla adulta.
Las anomalías en la secreción de GH y los bajos niveles de IGF-I contribuyen a la reducción de la talla final
Alteraciones del eje hipotálamo-hipófiso-suprarrenal
En la AN los niveles plasmáticos de cortisol pueden encontrarse elevados y el ritmo circadiano del cortisol está conservado (Figura 1). En pacientes afectas de TCA, a pesar del hipercortisolismo, no desarrollan fenotipo cushingoide. Este hipercortisolismo refleja la hipersecreción del factor liberador de hormona corticotropa (CRF) más que una resistencia al cortisol, y muchas pacientes presentan una supresión anormal de cortisol durante la prueba de frenación con dexametasona (Figura 1). Los niveles de ACTH se encuentran dentro de los límites de la normalidad.
Adipoquinas y péptidos reguladores del apetito
- La leptina es una hormona sintetizada por el tejido adiposo que desempeña un papel clave en la regulación de la ingesta y del gasto energético. Actúa a nivel hipotalámico disminuyendo el apetito y, por consiguiente, con la pérdida de peso; pero tiene otras funciones como la regulación del metabolismo óseo, las funciones cognitivas y neuronales, así como en el sistema inmune.
En pacientes con AN han sido descritos niveles bajos de leptina comparado con controles, y ello podría contribuir al desarrollo de la amenorrea hipotalámica, así como al ejercicio compulsivo que realizan estas pacientes.
- Los niveles de grelina (péptido hormonal gastrointestinal) están regulados por los cambios agudos y crónicos del balance energético. Sus niveles están elevados en las pacientes con AN, probablemente como una respuesta al bajo estado energético, y se correlacionan inversamente con el IMC y la masa grasa.
- Los niveles de adiponectina en las pacientes con AN pueden encontrarse normales, elevados o disminuidos. Niveles elevados podrían contribuir a la disminución de la masa ósea por incremento de la actividad osteoclástica.
- PYY es un péptido anorexigénico, producido por las células L del colon, en proporción a la ingesta calórica. Niveles elevados de PYY podrían contribuir a la reducida ingesta energética y a la disminución de la formación ósea en AN.
Alteraciones de la masa ósea
Las adolescentes con TCA presentan una disminución en la masa ósea, siendo la patogenia no completamente conocida, pero diversos estudios han observado diferentes factores, incluyendo el bajo aporte calórico con niveles bajos de IGF-I, aumento del cortisol, bajo peso corporal y disminución del tejido adiposo con bajos niveles de leptina.
En el momento del diagnóstico más del 50% de las adolescentes con AN y el 70% de los varones con AN presentan una densidad mineral ósea (DMO) de -1 zscore en al menos una o dos áreas. Aproximadamente el 11% tienen una densidad mineral ósea de -2 zscore al diagnóstico y un 30% tiene incremento de fracturas de riesgo. Las pacientes con bulimia presentan una reducción de la masa ósea en la columna lumbar, sugiriendo que la pérdida de masa ósea no explicaría el efecto deletéreo del TCA en el hueso.
Al diagnóstico algo más del 50% de las adolescentes con AN, presentan una densidad mineral ósea disminuida
La pérdida ósea en la AN acontece en huesos trabeculares y corticales, aunque es más evidente en los primeros. El grado de pérdida de masa ósea posiblemente depende de la edad a la que comenzó la amenorrea, así como de su duración. Las pacientes con amenorrea primaria muestran una pérdida de masa ósea más severa que aquellas con amenorrea secundaria. En la actualidad, se recomienda evaluación de la DMO en pacientes que han estado amenorreicas entre 6-12 meses.
La AN tiene efectos negativos sobre la DMO (tamaño y estructura ósea) y, estas alteraciones podrían explicar el incremento de riesgo de fractura. Los avances en técnicas de imagen, tales como la tomografía computerizada cuantitativa (QCT) y más recientemente la QCT de alta resolución periférica (HR-QCT) proporcionan información de la geometría ósea y de la DMO volumétrica tanto de la zona cortical como trabecular, relacionándose directamente ambas con las fracturas de carga(10).
El IGF-I es uno de los mas importantes reguladores de metabolismo óseo y sus niveles se correlacionan con la masa ósea en población normal. En las pacientes con AN, la deficiencia de IGF-I es debida al estado de malnutrición, y la recuperación lenta de peso tiende a la normalización de los niveles de IGF-I.
La leptina regula el remodelado óseo, y los niveles disminuidos observados en la AN podría ser uno los más importantes factores envueltos en la patogénesis de la fragilidad ósea, a través de la disminución de la formación del hueso cortical y del crecimiento del esqueleto.
En las pacientes con AN, el mecanismo de la pérdida ósea no parece ser debido a un incremento de la absorción sobre la formación. Los marcadores de formación ósea como la osteocalcina y fosfatasa alcalina específica, están disminuidos. Por el contrario, los marcadores de reabsorción ósea están aumentados. La osteoprotegerina (OPG) y el receptor activador del ligando nuclear del factor kappa B (RANKL) son esenciales en la remodelación ósea en pacientes con AN y pérdida de masa ósea. No obstante, el amplio déficit de calcio en estas pacientes y el déficit en aminoácidos, es posible que haga muy difícil la recuperación de la masa ósea. Los mejores predictores para la pérdida de masa ósea son el índice de masa corporal y la duración de la amenorrea, seguido de la duración de las menstruaciones regulares antes de la amenorrea.
Los predictores para la pérdida de masa ósea son el IMC y la duración de la amenorrea
Tratamiento
Las alteraciones hormonales descritas en estas pacientes, son consecuencia de la propia enfermedad, e igualmente la mayoría se normalizan tras la recuperación nutricional. Únicamente la presencia de la pérdida de la masa ósea sería susceptible de tratamiento, dado que la recuperación nutricional no va a llegar a normalizar la masa ósea.
Tratamiento con esteroides sexuales
Diferentes estudios han demostrado que los estrógenos en las adolescentes con masa ósea disminuida y amenorrea durante al menos un año no son eficaces. Las dosis elevadas de estrógenos presentes en los contraceptivos orales pueden contribuir a disminuir aún más los niveles de IGF-I, lo que explicaría el escaso efecto de esta terapia. Se ha observado que la administración de estrógenos (100 mcg de 17 b estradiol con progesterona cíclica) en forma de parches transdérmicos provoca una supresión escasa o nula sobre los niveles de IGF-I comparado con los contraceptivos orales, en adolescentes con AN, generando un incremento significativo de la densidad mineral ósea en un período de 18 meses.
Los efectos de estas diferencias podrían estar relacionadas con el tipo de estrógenos (17 b estradiol vs EE) y/o el método de administración (transdérmico vs oral).
Las dosis elevadas de estrógenos orales pueden contribuir a disminuir más los niveles de IGF-I, y por tanto no son eficaces
Tratamiento con IGF-I recombinante (rhIGF-I)
La administración de rhIGF-I a adolescentes con AN causa un incremento en los niveles de marcadores de formación ósea, pero no de reabsorción ósea. Además, el rhIGF-I en conjunción con una combinación de estrógenos y progesterona genera un incremento significativo de la densidad mineral ósea en las vértebras de la columna lumbar y en los niveles séricos de marcadores de formación ósea.
Tratamiento con Bifosfonatos
Los bifosfonatos tienen una larga vida media y una intensa afinidad por el hueso, como se demuestra por su absorción en su matriz, inhibiendo la reabsorción ósea osteoclástica. No han sido probados por la FDA para mujeres en edad fértil, debido al escaso conocimiento de la eficacia a largo plazo.
Los bifosfonatos no han sido aprobados por la FDA para mujeres en edad fértil, por sus efectos a largo plazo
Ejercicio físico
Es importante para la salud ósea en pacientes con TCA, ya que incrementa la densidad mineral ósea. No obstante, las recomendaciones de la actividad física en los TCA son controvertidas. En efecto, la actividad física en combinación con malnutrición, puede incrementar la pérdida de peso.
Tablas y figuras
Figura 1: Alteraciones endocrinas en los TCA
Bibliografía
- American Psychiatric Association: Diagnostic and Statistical Manual of Mental Disorders, 5th edn. Arlington, VA: American Psychiatric Association. 2013.
- M.T. Muñoz, J. Argente. Advances in anorexia nervosa. Journal of Pediatric Endocrinology and Metabolism. 2004. 17: 473–47.
- Schorr M, Miller KK.The endocrine manifestations of anorexia nervosa: mechanisms and management. Nat Rev Endocrinol. 2017;13: 174-186.
- Hinney A, Kesselmeier M, Jall S, Volckmar AL, Föcker M, Antel J et al. Evidence for three genetic loci involved in both anorexia nervosa risk and variation of body mass index. Mol Psychiatry. 2017;22:192-201.
- M.T. Muñoz-Calvo. Anorexia nervosa: An endocrine focus and procedure guidelines. Journal of Pediatric Endocrinology and Metabolism. 2005; 18 1181–1185.
- Sacco B, Kelley U. Diagnosis and Evaluation of Eating Disorders in the Pediatric Patient. Pediatr Ann. 2018;47:e244-e249.
- M T Muñoz, M Graell, J Argente. Anorexia Nervosa. In: Ilpo Huhtaniemi and Luciano Martini, (Eds.), Encyclopedia of Endocrine Diseases, Second Edition, 2019, vol. 5, pp. 205–215. Oxford: Academic Press. DOI: 10.1016/B978-0-12-812199-3.04111-6.
- Argente J, Barrios V, Chowen JA, et al. Leptin plasma levels in healthy Spanish children and adolescents, children with obesity and adolescents with anorexia nervosa and bulimia nervosa. Journal of Pediatrics. 1997; 131:833–838.
- Blanchet C, Guillaume S, Bat-Pitault F, Carles ME, Clarke J, Dodin V, et al. Medication in AN: A Multidisciplinary Overview of Meta-Analyses and Systematic Reviews. J Clin Med. 2019;8. pii: E278. doi: 10.3390/jcm8020278.
- Kandemir N, Becker K, Slattery M, Tulsiani S, Singhal V, Thomas JJ, et al. Impact of low-weight severity and menstrual status on bone in adolescent girls with anorexia nervosa.
Int J Eat Disord. 2017;50:359-369. - Berner LA, Feig EH, Witt AA, Lowe MR. Menstrual cycle loss and resumption among patients with anorexia nervosa spectrum eating disorders: Is relative or absolute weight more influential?. Int J Eat Disord. 2017;50(4):442-446.
- Frølich J, Hansen S, Winkler LA, Andresen AK, Hermann AP, Støving RK. The Role of Body Weight on Bone in Anorexia Nervosa: A HR-pQCT Study. Calcif Tissue Int 2017:101:24-33.
- Robinson L, Aldridge V, Clark EM, Misra M, Micali N. Pharmacological treatment options for low Bone Mineral Density and secondary osteoporosis in Anorexia Nervosa: A systematic review of the literature. J Psychosom Res. 2017; 98:87-97.
- Thornton D, Gordon CM. Restrictive Eating Disorders and Skeletal Health in Adolescent Girls and Young Women. Calcif Tissue Int. 2017;100(5):449-460.
- Mumford J, Kohn M, Briody J, Miskovic-Wheatley J, Madden S, et al. Long-term outcomes of adolescent anorexia nervosa on bone. J Adolesc Health. 2019;64:305-310. doi: 10.1016/j.jadohealth.2018.07.025. Epub 2018 Dec 11.
- Kandemir N, Slattery M, Ackerman KE, Tulsiani S, Bose A, Singhal V, et al. Bone Parameters in Anorexia Nervosa and Athletic Amenorrhea: Comparison of Two Hypothalamic Amenorrhea States. J Clin Endocrinol Metab. 2018;103(6):2392-2402.
- Singhal V, Sanchita S, Malhotra S, Bose A, Flores LPT, Valera R, et al. Suboptimal bone microarchitecure in adolescent girls with obesity compared to normal-weight controls and girls with anorexia nervosa. Bone. 2019 May;122:246-253. doi: 10.1016/j.bone.2019.03.007. Epub 2019 Mar 7.
- Miller KK, Meenaghan E, Lawson EA, Misra M, Gleysteen S, et al. Effects of risedronate and low-dose transdermal testosterone on bone mineral density in women with anorexia nervosa: a randomized, placebo-controlled study. J Clin Endocrinol Metab. 2011; 96:2081-2088.
- Herpertz-Dahlmann B. Treatment of eating disorders in child and adolescent psychiatry. Curr Opin Psychiatry. 2017; 30:438-445.
- Rienecke RD. Family-based treatment of eating disorders in adolescents: current insights. Adolesc Health Med Ther. 2017; 1:69-79.