Probióticos en adolescentes: indicaciones clínicas y evidencia actual
C. Coronel Rodríguez(1), A. Hernández Hernández(2).
(1)Centro de Salud “Amante Laffón”. Sevilla. (2)Centro de Salud Tacoronte. Tenerife. Miembros del Grupo de trabajo de Nutrición de la Sociedad Española de Pediatría Extrahospitalaria y Atención Primaria (SEPEAP).
Fecha de recepción: 22-01-2021
Fecha de publicación: 28-02-2021
Adolescere 2021; IX (1): 62-75
Resumen
|
Las alteraciones en la composición de la microbiota intestinal han sido asociadas al desarrollo de múltiples y diversas patologías de tipo autoinmunes, cardiovasculares, alérgicas o problemas cognitivos, pero principalmente en problemas gastrointestinales. Aún no está claro si dichas alteraciones son la causa y/o la consecuencia de dichas enfermedades habiendo aún más dudas que certezas. Las sociedades científicas realizan estudios, sobre todo evolutivos, y hacen revisiones periódicas de la bibliografía existente actualizando las recomendaciones con la evidencia disponible, sobre los beneficios encontrados en el empleo de cepas específicas a dosis determinadas y en patologías concretas. Donde más estudios hay, y más se ha avanzado en su aplicabilidad en la práctica clínica, es en el aparato digestivo. Concretamente en el síndrome de intestino irritable y en la prevención, y tratamiento, de diversas causas de diarrea, pero es un campo en gran expansión y desarrollo del que se espera grandes avances en un futuro inmediato.
Palabras clave: Guías sobre uso de probióticos; Prebióticos; Probióticos; Indicaciones de probióticos.
|
Abstract
|
Abnormalities in the composition of the intestinal microbiota have been associated with the development of multiple and diverse pathologies of autoimmune, cardiovascular, allergic or cognitive problems, but mainly gastrointestinal problems. It remains unclear whether these abnormalities are the cause and / or the consequence of these diseases, raising even more doubts than certainty. Scientific societies undertake studies, especially evolutionary ones, and make periodic reviews of the existing bibliography, updating the recommendations with the available evidence, on the benefits found in the use of specific strains at certain doses and in particular pathologies. It is in the digestive system where more studies and where more progress has been made in its applicability in the clinical practice. Specifically, this has been in irritable bowel syndrome and in the prevention and treatment of various causes of diarrhea, but it is a field in great expansion and development from which great advances are expected in the immediate future.
Key words: Probiotic use guidelines; Prebiotics; Probiotics; Indications of probiotics.
|
Información básica sobre la microbiota
Adquisición y colonización de la microbiota intestinal(1,2)
La microbiota se adquiere antes, durante y principalmente después del parto, mediante la lactancia materna, queda establecida de forma estable a los 2-3 años de vida, es en su mayoría específica de cada persona, pero puede modularse a lo largo de la vida por multitud de factores.
Se considera que desde los 2-3 años dicha flora intestinal es estable y más o menos específica de cada persona, es como su huella dactilar, al menos en 2/3 de la misma, siendo el resto más común a otros individuos de su área geográfica. Puede variar de un individuo a otro, o incluso en el mismo individuo por diferentes circunstancias (tipo de dieta, estilo de vida, estrés, infecciones, ingestión de antibióticos, etc.) que pueden producir cambios transitorios o prolongados. Estos cambios, a su vez, pueden condicionar patologías a posteriori como la obesidad, alteraciones cardiovasculares, enfermedades alérgicas o inflamatorias. El propio envejecimiento origina una inmunosenescencia, con agotamiento de células T y cambios en la flora intestinal, consistente en un incremento de anaerobios facultativos, a la vez que disminuyen las bacterias beneficiosas como lactobacillusy bifidobacterias.
Composición de la microbiota
La composición de la microflora es muy variable de unas zonas de nuestro cuerpo a otras. Prácticamente todas las partes expuestas de nuestro organismo están ocupadas por ella, desde la piel, vías respiratorias superiores e inferiores, aparato reproductor femenino y masculino, etc., pero es el aparato gastrointestinal y en concreto el colón donde es más abundante y variada y donde ejerce importantes funciones, no solo locales sino extraintestinales, es lo que se ha llamado “el órgano olvidado”.
La composición de la microflora es muy variable de unas zonas de nuestro cuerpo a otras
Funciones de la microbiota
Funciones de la microbiota intestinal: función metabólica, de barrera intestinal y de modulación inmunológica, interacción intestino-cerebral.
Cada día se descubren nuevas funciones de la microbiota intestinal y su influencia en la fisiología del hospedador. Las más conocidas son la metabólica e inmunológica, pero tienen otras muchas funciones no menos importantes que se describen en la Tabla I(1-5).
Definiciones y conceptos básicos
Antes de profundizar en el tema es muy importante conocer la terminología más frecuentemente usada y que a veces da lugar a confusión por usar como sinónimos términos que son diferentes.
Se detalla en la Tabla II(1-5).
Introducción
Existen múltiples evidencias científicas que indican que la microbiota intestinal regula muchos aspectos de la fisiología de su huésped. Así, una microbiota sana (eubiosis) contribuye a la salud global del huésped mientras que las alteraciones en su composición (disbiosis) han sido asociadas al desarrollo de múltiples y diversas patologías como enfermedades autoinmunes, cardiovasculares, alérgicas o problemas cognitivos, pero principalmente en problemas gastrointestinales.
En muchas ocasiones no está aún claro que dichas alteraciones de la microbiota puedan ser la causa y no la consecuencia de dichas patologías habiendo más dudas que certezas.
Una microbiota sana (eubiosis) contribuye a la salud global del huésped mientras que las alteraciones en su composición (disbiosis) han sido asociadas al desarrollo de diversas patologías
Los probióticos pueden actuar sobre el huésped mediante diferentes mecanismos: metabólicos: sintetizando determinadas sustancias que luego son absorbidas por la mucosa intestinal, de barrera: contribuyendo al trofismo y reparación de la misma, mediante su colonización y producción de bacteriocinas que impiden anidación de patógenos, de inmunorregulación: al producir diferentes efectos sobre el sistema inmunológico y de intercomunicación intestino-cerebro: favoreciendo la recuperación de diferentes patologías psico-neurológicas.
La palabra y el concepto de “probiótico” como microorganismos que proporcionan bienestar, salud y hasta felicidad se han convertido en un plus de publicidad de ventas que pueden resultar engañosos por lo que desde 2006 surge el Reglamento 1924/2006 que obliga a los fabricantes hacer declaración de las posibles propiedades saludables de los mismos y someterlas a la Comisión Europea y ser evaluadas, avaladas o rechazadas por la EFSA (European Food Safety Authority)(1-5).
Se debe tener en cuenta que los probióticos han de ser seguros (GRAS: Generally Regarded As Safe): no ser patógeno, no causar reacciones inmunes dañinas, no ser portador de resistencias a antibióticos. Los efectos clínicos de los probióticos se consideran cepa-específicos y dosis dependientes, aunque algunos de sus beneficios pueden ser compartidos por cepas pertenecientes al mismo género o especie. La mayoría son específicas de determinadas cepas, lo cual es importante para valorar e interpretar la evidencia científica y realizar sus indicaciones en la práctica clínica(1-5).
Los probióticos han de ser seguros, no ser patógeno, no causar reacciones inmunes dañinas y no ser portador de resistencias a antibióticos
Además, es muy importante destacar que los estudios en animales no se contemplan como nivel de evidencia, por muy bien diseñados que estén, puesto que esto solo implica una posible utilidad de futuro en humanos. La ventaja de hacer estudios con modelos animales es que se pueden acotar muchas variables y se pueden hacer diversos tratamientos sin gran problema. Sin embargo, también presentan el inconveniente de que la semejanza con trastornos humanos es escasa, y en los estudios en humanos, resulta difícil obtener conclusiones definitivas pues usan probióticos de diferente cepas, en dosis diferentes o incluso acompañadas de excipientes u otros pro y/o prebióticos o número de participantes y tiempos de prueba muy variables. La falta de una mayor investigación es necesaria, pues los estudios sobre los efectos e indicaciones siguen siendo controvertidos y la evidencia existente no se considera concluyente.
Se trata de un campo en gran expansión y desarrollo, aún con muy pocas evidencias y gran presión de la industria farmacéutica. Existen múltiples probióticos disponibles, sin embargo, son pocos los que han demostrado un beneficio claro en la salud humana y ninguno es capaz de producir todos los efectos a la vez. Identificamos que existen brechas de conocimiento significativas en esta área de investigación, aunque sea muy prometedora e importante debido a la heterogeneidad y variabilidad significativa entre los estudios y cepas probióticas implicadas. Para entender los trabajos no nos podemos ir al titular o a las conclusiones, sino debemos hacer una lectura crítica del mismo, y ver cómo se han obtenido esos resultados(6). Muchas veces los resultados son publicitados, y publicados con gran repercusión mediática, en medios de comunicación y de divulgación no científica antes de ser aceptado en revistas que exigen una revisión por pares y exenta de conflictos de intereses.
Existen múltiples probióticos disponibles, sin embargo, son pocos los que han demostrado un beneficio claro en la salud humana y ninguno es capaz de producir todos los efectos a la vez
Las sociedades científicas manejan diferentes estudios, sobre todo evolutivos en el tiempo, por lo que hay que quedarse siempre con la última versión o más actualizada que es la que incluye más trabajos y hace una revisión más completa. Las recomendaciones de estas sociedades se basan en meta-análisis y revisiones sistemáticas publicadas sobre los beneficios encontrados en el empleo de cepas específicas a dosis determinadas, en patologías concretas. De ellas la Organización Mundial de Gastroenterología (WGO por sus siglas en inglés de la World Gastroenterology Organisation), ha elaborado una guía práctica para el uso de probióticos y prebióticos(7) que constituye una excelente fuente en la que se pueden consultar sus aplicaciones clínicas, así como la evidencia científica que la sustenta. Un resumen de las aplicaciones clínicas más relevantes recogidas en esta guía se incluye en la Tabla III(7).
Para conocer mejor el grado de evidencia y de recomendaciones es importante conocer previamente los estudios en los que estos están sustentados. Recomendamos por ello la consulta de la Biblioteca de Guías de Práctica Clínica del Sistema Nacional de Salud (https://portal.guiasalud.es/egpc/lupus-niveles/) concretamente la ADAPTACIÓN DEL NICE (National Institute for Health and Care Excellence) de los niveles de evidencia del Oxford Centre for Evidence Based Medicine.
El objetivo de este artículo, no es solo ver las principales indicaciones de los probióticos en las patologías que puedan afectar a los adolescentes, con la evidencia disponible y expectativas de futuro en aquellos campos en los que hay más estudios que se detallan a continuación, sino además hacer un amplio repaso de una serie de conceptos sobre microbiota, como esta se inicia desde o antes del nacimiento, cómo se modula a lo largo de la vida, las funciones que ejerce sobre nuestro organismo para mejorar nuestra salud y como su alteración o disbiosis puede estar en la base en algunas patologías que pueden afectar a las personas en cualquier periodo de su vida y ser corregidas por el uso de probióticos u otros nutracéuticos.
Indicaciones
Las principales indicaciones de estos nutracéuticos en los adolescentes se detallan a continuación:
Probióticos y respuesta inmune
Hay diferentes estudios que muestran la viabilidad de utilizar los probióticos para modular el sistema inmunológico, prevenir infecciones y controlar el proceso inflamatorio.
Dadas sus propiedades inmuno-moduladoras, se han utilizado para la prevención y/o tratamiento de alergias. Respecto al tratamiento de la alergia hay unos pocos ensayos que indican que algunas cepas podrían tener cierta eficacia, pero se necesitan más estudios en humanos, doble ciego, controlados con placebo, para tener evidencias definitivas de esta actividad. Al contrario de lo que se ha observado en su uso terapéutico, los probióticos han mostrado un mejor comportamiento en la prevención de las alergias.
Las pruebas indican que los probióticos no modifican el curso natural de la alergia a los alimentos.
Los probióticos no modifican el curso natural de la alergia a los alimentos
Dermatitis atópica o eczema
Se ha demostrado que el uso de probióticos durante la gestación, lactancia y el primer año de vida, previene el desarrollo de dermatitis atópica en un subgrupo de niños que, por sus características y antecedentes familiares, tenían un gran riesgo de desarrollar patología de tipo alérgico. Los mejores resultados preventivos se observan cuando se realiza la suplementación prenatal del probiótico, mientras que si esta es después del nacimiento no muestra reducciones tan significativas del riesgo(7,8).
Concretamente se ha demostrado un posible efecto beneficioso de Lactobacillus rhamnosus GG (LGG) o Bifidobacterium lactis Bb-12entre 4 y 8 semanas mejoró con pequeñas diferencias el Scoring Atopic Dermatitis (SCORAD) o alivió los síntomas de la enfermedad en varios estudios pequeños, aunque este efecto fue más notable en el comienzo de los tratamientos. La edad de la población diana que más se puede beneficiar de esta intervención o la duración de esta no se puede establecer de modo certero(4,9).
Recientemente, se ha publicado un estudio que ha demostrado la eficacia de otras cepas diferentes a las mencionadas, en concreto de Bifidobacterium lactis CETC 8145, Bifidobacterium longumCECT 7347 y Lactobacillus caseiCETC 9104 en la reducción del índice SCORAD en pacientes jóvenes con dermatitis atópica moderada. Otras cepas probióticas, Lactobacillus platarum CJLP133, Lactobacillus fermentum VR1-003PCC y L sakei KCTC 10755BP también están siendo estudiadas en la dermatitis atópica. Además, se está comenzando a investigar la aplicación tópica de Vitreoscilla filiformis(4,9).
Aunque los resultados de los estudios analizados muestran resultados prometedores de los pro, pre y simbióticos en la prevención y tratamiento de la dermatitis atópica, antes de una recomendación franca en la práctica clínica diaria, aún falta por confirmar el beneficio de estos agentes, la combinación óptima de los mismos, la dosis de cada componente, la duración del tratamiento y, la edad y el grupo, de pacientes diana. Además, queda también pendiente determinar si la reducción de la gravedad de la dermatitis atópica puede mantenerse a lo largo del tiempo tras la suspensión del tratamiento, o si existen rebrotes una vez finalizada la intervención.
Aún falta por confirmar el beneficio de los pro, pre y simbióticos, la dosis de cada componente, la duración del tratamiento y la edad y el grupo de pacientes diana
Rinitis alérgica y asma(2,5,9,10)
Los estudios clínicos para evaluar el uso de los probióticos en pacientes con rinitis alérgica y asma son limitados y los resultados obtenidos, controvertidos, por lo que no se pueden extraer conclusiones firmes. Algunas cepas de Bifidobacterium longum, L. acidophilus y L. casei han demostrado ser eficaces en algunos casos para reducir la severidad de los síntomas. Otros parámetros de las enfermedades alérgicas, como las sibilancias, el asma o la rinitis alérgica tuvieron resultados contradictorios respecto a la medicación o el número de episodios alérgicos.
Hay descrito que un simbiótico, mezcla de la cepa Bifidobacterium breve M-16V con varios prebióticos, reduce significativamente la producción de citocinas Th2 y mejora el pico espiratorio forzado después del reto alergénico en adultos asmáticos y alérgicos a los ácaros.
Infecciones respiratorias
Los probióticos podrían ser útiles para la prevención de las infecciones como en la gripe, la otitis media y la neumonía nosocomial. Algunos estudios reflejan un posible efecto de los probióticos sobre el número de episodios infecciosos, mientras que otros lo hacen sobre los síntomas. Se ha observado un beneficio potencial para reducir la incidencia de otitis en niños. Sin embargo, todavía no hay estudios concluyentes que identifiquen las cepas probióticas más eficaces en la prevención y/o tratamiento de estas infecciones.
Los probióticos pueden ser útiles para la prevención de infecciones como la gripe, otitis media y neumonía nosocomial
Prevención de infecciones recurrentes
Un intestino con alteraciones de la permeabilidad como resultado de una disbiosis, ofrece un cambio de respuesta inmune y a su vez a cambios fenotípicos de las células implicadas en dicha respuesta. Esta teoría hace que haya datos prometedores sobre los efectos de los probióticos como adyuvantes de la inmunización, aunque son necesarios nuevos estudios bien diseñados, con el poder suficiente para comprender sus propiedades inmunomoduladoras. Aunque son un mercado muy creciente y en rápida expansión, pensamos que no son todo lo eficaces que defienden dado que de ser así las infecciones habrían disminuido considerablemente y esto no sucede así. Si bien se está avanzando en la prevención de las diarreas de etiología víricas en las guarderías(7).
Probióticos y neurodesarrollo
Los posibles mecanismos de acción son(4-6):
- Que los microorganismos actúen directamente sobre el sistema nervioso entérico mediante la producción o modulación de neurotransmisores (serotonina, ácido gamma-aminobutírico o
acetilcolina, etc.), que a su vez se comunica con el SNC. Se ha demostrado que algunas bacterias intestinales de los géneros Lactobacillus y Bifidobacterium están implicadas en la regulación de muchos procesos fisiológicos y neurológicos, cuya disfunción se relaciona con la ansiedad o la depresión.
- Que regulen el sistema inmunitario intestinal, el cual produce citoquinas que modulan SNC.
- Que produzcan metabolitos que alteren la actividad de la barrera hemato-encefálica.
En un artículo de revisión de 2015(2,4), sobre el potencial de los psicobióticos en la salud mental, se analizaron los estudios que cumplían los requisitos de realizarse en humanos, con sistema de doble ciego, asignación aleatoria y donde se comparasen los efectos de psicobióticos y placebos. No se encontraron pruebas concluyentes de los efectos psicológicos, además, los probióticos usados no estaban bien caracterizados, indicaban la especie (Lactobacillus acidophilus, Lactobacillus casei y Bifidobacterium bifidum, pero no la cepa. Comunicaron que su consumo se asoció a una disminución del estrés y a una mejora de la memoria. En otro trabajo, el Bacteroides fragilis corrige la permeabilidad intestinal y las alteraciones metabólicas consecuentes con una mejora en la comunicación, los movimientos estereotipados y la ansiedad.
Se ha comunicado que el consumo de probióticos se asociaba a una disminución del estrés y una mejora de la memoria
La depresión es una de las enfermedades que más preocupan a los responsables de la Organización Mundial de la Salud. Hoy es la tercera causa de enfermedad y discapacidad entre los adolescentes, pero se calcula que en 2030 se convertirá en la primera. Los investigadores han encontrado una reducción de dos géneros de bacterias (Coprococcus y Dialister) en la microbiota de las personas deprimidas, incluso después de excluir los posibles efectos de los fármacos antidepresivos. Este estudio abre además muchas posibilidades de futuro, al poder usar el Dialister y Coprococcus como próximos psicobióticos con potencial beneficio a los pacientes con depresión. También observaron que la proporción de la bacteria Flavonifractor había aumentado en los pacientes con depresión mayor y que Butyricoccus estaba asociado al tratamiento con antidepresivos.
Los probióticos en los TEA podrían mejorar los síntomas gastrointestinales y las alteraciones de
la conducta
Se ha planteado que la utilización de probióticos podría mejorar no solo los síntomas gastrointestinales de los pacientes con trastornos del espectro autista (TEA) sino también las alteraciones en la conducta. Se ha demostrado que la administración de Bacteroides fragilis mejora los problemas de comportamiento y restablece la permeabilidad digestiva y los cambios en la composición de la microbiota. Esta relación parece que es dependiente del nervio vago. Se necesitan más estudios para aclarar mejor los efectos de Lactobacillus plantarum PS128, sobre todo, en los niños más pequeños con TEA que presentan mayor sintomatología(2,4,5).
La utilización de dietas especiales, el uso del trasplante fecal y el empleo de psicobióticos abre una puerta a la esperanza al beneficio que puede aportar la modificación de la microbiota intestinal en estos pacientes. Aun así, es necesario mantener la cautela, ya que uno de los objetivos principales en estos niños y adolescentes es el de mejorar su calidad de vida y no debemos caer en el error de crear falsas esperanzas a pacientes y familiares. Los estudios realizados con trasplante de microbiota fecal en estos niños no son ensayos doble ciego y controlados frente a placebo y, además, hay que tener en cuenta la subjetividad en la percepción de la mejora de los síntomas psicológicos por parte de los cuidadores(6).
Alteraciones metabólicas
Cada vez hay mayor evidencia sobre el hecho de que la microbiota intestinal puede ejercer un alto impacto sobre el estado nutricional y la salud del hospedador, a través de la modulación neuro-inmuno-endocrina. Estudios experimentales sugieren que las desviaciones en la microbiota intestinal predisponen al aumento de los depósitos de grasa y a la obesidad. Los estudios realizados ofrecen un panorama prometedor, pero hasta el momento se trata solo de estudios piloto, que incluyen pocos pacientes y no tienen en cuenta la multitud de factores que influyen en la patogenia de esta enfermedad, por lo que es necesaria mayor investigación y tomar estos datos como preliminares.
Obesidad
Se han observado que diferencias tempranas en la microbiota de los niños parecen predecir la aparición posterior de sobrepeso, variando su composición entre individuos obesos y de peso normal. Por otra parte, la eficacia del cambio del estilo de vida sobre la pérdida de peso corporal parece ser influido por la composición de la microbiota del individuo. Se ha podido establecer que los niños con sobrepeso a temprana edad presentan aumento de Staphylococcus aureus en las heces mientras que aquellos que mantienen un peso adecuado, predominan Bifidobacterium.
En los pacientes obesos con resistencia a insulina, leptina y un fenotipo inflamatorio se han encontrado disminución de cantidad de genes microbianos en heces, con predominio de formicutes sobre Bacteroidetes, así como un mayor número de genes que codifican enzimas que hidrolizan polisacáridos mejorando la obtención de energía. Por otra parte, se ha visto la presencia de Akkermansia muciniphila asociado con un estado metabólico saludable, glucosa y homeostasis del tejido adiposo(11).
Hay trabajos que indican que los probióticos pueden ayudar a los niños y adolescentes obesos a perder peso. En concreto en un trabajo en Italia, los expertos pusieron a 100 niños y adolescentes obesos (de 6 a 18 años) en una dieta con control y restringida en calorías y se le administró al azar los probióticos ‘Bifidobacterium breve BR03’ y ‘Bifidobacterium breve B632’, o un placebo durante 8 semanas.
Se llevaron a cabo análisis clínicos, bioquímicos y de muestras de heces para determinar el efecto de la suplementación con probióticos sobre el aumento de peso, la microbiota intestinal y el metabolismo. Los resultados sugirieron que los niños que habían tomado probióticos tenían una mayor reducción en la circunferencia de la cintura, mayor disminución de peso y del índice de masa corporal, en la resistencia a la insulina y en la presencia de la bacteria ‘E. coli’ en su intestino, en comparación con los niños que solo estaban a dieta. Estos efectos beneficiosos demuestran el potencial de los probióticos para ayudar a tratar la obesidad en niños y adolescentes, pero se trata aún de estudios preliminares comunicados en congresos (e-ECE 2020. Presented September 7, 2020. Abstract OC3.5) no exentos de conflictos de intereses.
En un estudio en adolescentes obesos, aquellos que tomaron probióticos tenían mayor reducción del perímetro de cintura, disminución del peso, del IMC y de resistencia a la insulina, en comparación con los obesos que estaban solo con dieta
Metabolismo de los lípidos
Las dietas con alto contenido de alimentos de origen animal se han considerado durante mucho tiempo un factor de riesgo de enfermedades cardiovasculares, ya que dichas dietas son una fuente importante de trimetilamina que es convertida por el hígado en otro compuesto, trimetilamina N-óxido, que promueve la acumulación de placa grasa en las arterias. La evidencia sugiere que las bacterias del género ‘Bilophila’, a través de un código genético expandido, permite que su metabolismo, a través de una vía de desmetilación, evite la producción de esta última. Además, la investigación muestra que las dietas basadas en productos vegetales causan un rápido aumento de la ‘Bilophila’ en el intestino.
Algunos estudios con animales de experimentación han mostrado la disminución del colesterol sérico tras el consumo de probióticos. Estos hallazgos, sugieren la posibilidad de tratamientos con probióticos para la reducción de la aterosclerosis, pero se necesitan más estudios que demuestren los beneficios en humanos para corroborar el efecto, así como el mecanismo de acción. En una reciente revisión sistemática de estudios clínicos se ha señalado un papel de los probióticos en la disminución de la concentración plasmática de lipoproteínas de baja densidad (LDL) y colesterol total. Aunque el nivel de evidencia no es contundente, incluso no se observan diferencias significativas entre el consumo de probióticos y bebidas lácteas fermentadas(4).
En una reciente revisión se señala un papel importante de los probióticos en la disminución del C-LDL y CT, aunque el nivel de evidencia no es contundente
Aparato genitourinario(4,5)
La vagina contiene una microbiota específica representada principalmente por Lactobacillus, que se asocia a una condición saludable y que alcanza las proporciones más altas en mujeres embarazadas con parto a término. En menor proporción, también se pueden encontrar microbiotas asociadas con la piel y el tracto intestinal, como Prevotella, Gardnerella, Atopobium, Sneathia, Bifidobacterium, Megasphaera y Anaerococcus. Los lactobacilos en la vagina están particularmente asociados con la edad fértil, la producción de estrógeno, producir ácido láctico, acidificando el ambiente a valores de pH entre 4 y 4,5 y actuando como barrera a la colonización por otros microorganismos. Una baja tasa de lactobacilos se ha correlacionado con una menor tasa de embarazo en los procedimientos de reproducción asistida.
Las vaginosis bacterianas se han relacionado con, el aumento de la proporción de anaerobios como Gardnerella, Prevotella, Megasphaera, Atopobium y Dialister en detrimento de los lactobacilos(11).
La microbiota vaginal juega un papel importante en la prevención de infecciones en el tracto genital y urinario femenino. Las bacterias ácido-lácticas son dominantes en el tracto vaginal de las niñas saludables y forman una barrera que protege de la colonización de patógenos por distintos mecanismos y han sido valorados para tratar pacientes con infecciones en esta área. El objetivo es favorecer la restauración de la microbiota vaginal y/o prevención del desarrollo de infecciones del tracto genital femenino, incrementar la calidad de vida de la mujer favoreciendo su salud reproductiva, acortar el tratamiento farmacológico contra infecciones vaginales, desempeñar un papel clave como coadyuvante en el tratamiento de las infecciones del tracto vaginal y disminuir las patologías obstétricas y ginecológicas de importante impacto social y económico.
Los probióticos vaginales son seguros, no causan efectos secundarios en el organismo y no tienen riesgos de ser cancerosos. Para su aplicación se conocen dos versiones: vía vaginal o vía oral. Pero de acuerdo a los especialistas, el producto es más eficaz y seguro por vía vaginal. En este supuesto, se dispone de las presentaciones en cápsulas, comprimidos, tampones y óvulos que están empapados de los lactobacilos con una efectividad similar.
Por otro lado, se ha observado una mayor restitución de la microbiota vaginal normal con el tratamiento vía oral respecto a placebo. El hecho de que el recto actúe como un reservorio para los lactobacilos vaginales sugiere que la ingestión de cepas probióticas podría ser una ruta de administración alternativa a la vaginal. Igualmente, se aprecia una disminución en las recidivas con el tratamiento vía vaginal respecto a placebo en pacientes con vaginosis. Existen evidencias de que son capaces de disminuir el PH vaginal, lo que evita la proliferación de gérmenes en la zona genital y que muestran su actividad reconstituyendo la microbiota afectada, mejoran las tasas de curación, disminuyen las recurrencias de la vaginosis bacteriana y de las infecciones del tracto urinario, mejorando las tasas de curación de la vulvovaginitis candidiásica y evitando las reinfecciones. No obstante, son necesarios más estudios y de mejor diseño para su recomendación sistemática.
La utilidad de los probióticos en la prevención de la infección urinaria (ITU) en las mujeres es debida a que la inmensa mayoría de estas infecciones son producidas por bacterias que viven en el intestino grueso (especialmente Escherichia coli) y que, tras su salida, contaminan la región perianal y a partir de aquí pueden acceder a la uretra y desde allí a la vejiga urinaria.
La importancia de los probióticos en la ITU radica en su capacidad profiláctica, toda vez que numerosos estudios avalan los diferentes mecanismos de acción, efectividad y alcance, cuando son indicados vía oral o vaginal en los diferentes grupos etarios.
En relación con la prevención de las ITUs, su utilidad ha sido especialmente documentada en mujeres adolescentes y con ciertas cepas de Lactobacillus. Basándose en este principio, se observó que la ingestión continuada de dosis elevadas de L. rhamnosus GR1 y de L. reuteri RC14, resultaba su aislamiento en la vagina a partir de una semana de tratamiento. Aunque existen resultados esperanzadores deberían de realizarse más ensayos clínicos en este sentido que demuestren su eficacia.
Algunos de estos probióticos (yogur y arándanos) son recomendables para prevenir y mejorar las cistitis. Y además, en casos de tratamiento con antibióticos para evitar ITUs y candidiasis vaginales
Algunos de estos pre y probióticos se pueden encontrar en alimentos como el yogur o los arándanos rojos (o en su cápsula), ello ha supuesto que se recomiende consumirlos para ayudar a prevenir y mejorar la cistitis. Asimismo, conviene tomar probióticos en el caso de haber estado en tratamiento con antibióticos para evitar la aparición de las infecciones urinarias y candidiasis vaginales.
Mastitis subagudas y subclínicas(4,5,12)
La secreción de leche aumenta la humedad de los conductos galactóforos y crea condiciones apropiadas para el establecimiento de organismos patógenos en ellos. Recientemente se ha demostrado que el empleo de ciertas cepas probióticas, administrados por vía oral, pueden colonizar los conductos e impedir el asentamiento de bacterias indeseables. De esta forma se puede prevenir, e incluso curar, las mastitis, disminuyendo de una manera importante el dolor producido en las mastitis subagudas y que es una causa fundamental del abandono prematuro de la lactancia materna, por lo que se debe recomendar su empleo ante la presencia de los primeros síntomas.
Algunas cepas de Lactobacilos salivarius y L. fermentum aisladas de la leche humana parecen ser una buena opción para el tratamiento de las mastitis agudas y las mejores candidatas para el tratamiento de las mastitis subagudas ya que son eficaces en más de un 90% de los casos
Algunas cepas de Lactobacilos salivarius y L. fermentum aisladas de la leche humana parecen ser una buena opción para el tratamiento de las mastitis agudas y las mejores candidatas para el tratamiento de las mastitis subagudas ya que son eficaces en más de un 90% de los casos.
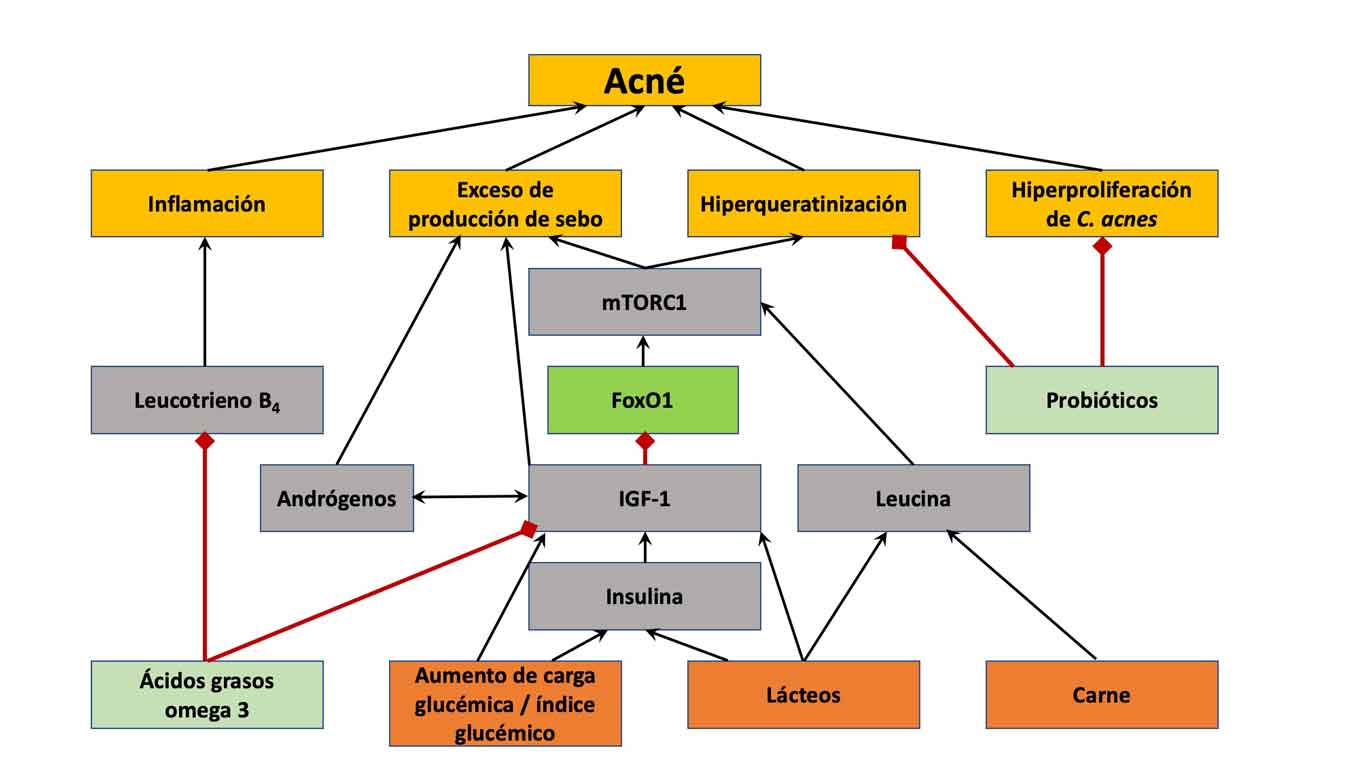
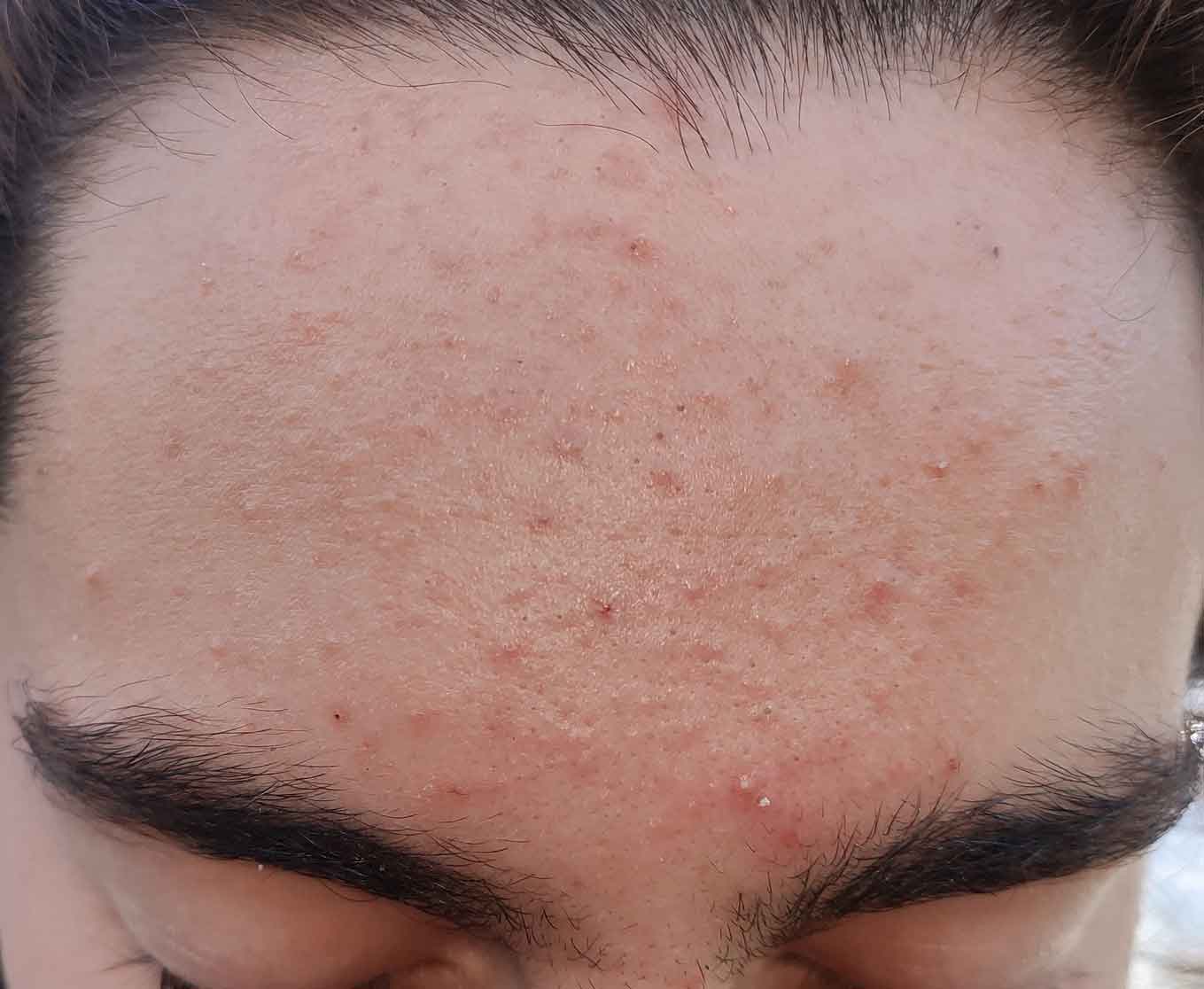
Acné
En el tratamiento del acné, se promociona que una asociación de probióticos (mezcla de Lactobacillus bulgaricus, Lactobacillus acidophilus, Bifidobacterium bifidum, Lactobacillus rhamnosus y Bifidobacterium animalis lactis) reduce el número de lesiones inflamatorias un 78% en 12 semanas y mejora la evaluación subjetiva de los pacientes. Además, es un tratamiento seguro y bien tolerado. Pero no hay muchos trabajos que apoyen esta indicación.
Aparato digestivo
Es sobre el que hay más estudios y más se ha avanzado en su aplicabilidad en la práctica clínica, concretamente en estas entidades que se detallan:
Enfermedad inflamatoria intestinal (EII)
Hay escasas evidencias sobre las recomendaciones del uso de probióticos en la edad pediátrica en el tratamiento y prevención de la enfermedad inflamatoria intestinal. De hecho, la Asociación Americana de Gastroenterología (AGA) recomienda el uso de probióticos solo en el contexto de un ensayo clínico, pero cada vez hay más trabajos que demuestran que la suplementación con probióticos en el tratamiento de la EII presenta efectos beneficiosos, como el de restablecer la homeostasis bacteriana en el intestino, regular el proceso inflamatorio, y restablecer el equilibrio de la microbiota intestinal, incrementando el número de especies “protectoras” y disminuyendo la carga patógena(5,7,12).
Hay cada vez más estudios que demuestran que la suplementación con probióticos presenta efectos beneficiosos en la EII
Son diversas las especies estudiadas en los diferentes tipos de EII. Dichos probióticos aparecen recogidos en diferentes guías clínicas como la de la WGO(7) y la guía canadiense(12) con recomendaciones sobre su aplicación y efectividad. Así, se ha observado que ciertas cepas han demostrado ser seguras y eficaces para el tratamiento de mantenimiento de la colitis ulcerosa leve-moderada tanto en adultos como en niños. En WGO 2017(7), para la edad pediátrica, con evidencia 2 se recomienda Escherichia coli Nissle 19175 × 1010 bact. viables, 2 veces al día, para el mantenimiento y la remisión en la colitis ulcerosa. El VSL#3® de 2 a 9 × 1011 UFC, 2 veces al día, tanto para el tratamiento como para la prevención y mantenimiento de la remisión de la colitis o pouchitis ulcerosa de actividad leve.
En estudios realizados en colitis ulcerosa activa en pacientes tratados con mesalacina, se demostró mayor remisión al asociarle de S. boulardii o E. coli no patógena (Nissle 1917), lo que sugiere que el tratamiento con probióticos puede suponer una alternativa como mantenimiento de la remisión de estos pacientes. Similares resultados se obtuvieron empleando Lactobacillus GG. Enemas con E. coli Nissle 1917 en pacientes con CU izquierda han demostrado respuesta clínica y disminución del tiempo en remisión en aquellos pacientes con dosis altas.
Hay evidencia sólida que en pacientes en remisión, alérgicos o intolerantes a 5-ASA, la mezcla de probióticos VSL#3 (5×1011 células/g de 3 cepas de bifidobacterias, 4 cepas de lactobacilos y 1 cepa de Streptococcus salivarius ssp. thermophilus) es capaz de mantener la remisión en el 75% de los casos al año de seguimiento y asociada a balsalazida induce la remisión de manera más precoz, así como su mantenimiento que cuando esta se usa sola. Resultados similares se han obtenido al demostrar menor puntaje de actividad clínica de CU en pacientes que recibieron leche fermentada (cepas de B. breve Yakult, B. bifidum y L.acidophillus).
Para la enfermedad de Crohn, las directrices señalan que los probióticos son menos efectivos y no hay evidencia suficiente para probar un beneficio o confirmar la falta de daño, habiéndose ensayado con diferentes tipos de probióticos.
En la enfermedad de Crohn, los diferentes tipos de probióticos son menos efectivos y no hay suficiente evidencia científica
En adultos y niños con pouchitis, la AGA recomienda la combinación de 8 cepas de L paracasei subsp paracasei DSM 24733, L plantarum DSM 24730, L acidophilus DSM 24735, L delbrueckii subsp bulgaricus DSM 24734, B longum subsp longum DSM 24736, B breve DSM24732, B. longum subsp infantis DSM 24737, y S. salivarius subsp thermophilus DSM 24731 sobre ninguno u otros probióticos(13).
Infección por Helicobacter pylorii
Se ha probado con la administración de cepas únicas o de un conjunto de cepas tanto del probiótico S. boulardii como los del género Lactobacillus spp y se han mostrado ser eficaces en la erradicación de la H. pylori cuando se utilizan como coadyuvantes a la terapia triple estándar (inhibidor de la bomba de protones, amoxicilina y claritromicina o metronidazol y claritromicina) y no así como terapia aislada.
La administración de cepas únicas o de un conjunto de cepas tanto del probiótico S. boulardii como los del género Lactobacillus spp han mostrado ser eficaces en la erradicación de la H. pylori cuando se utilizan como coadyuvantes a la terapia triple estándar
Se ha descrito que varias cepas de lactobacilos y bifidobacterias pueden reducir los efectos colaterales de las terapias con antibióticos y la gastritis asociada al patógeno. En este sentido, se considera que el empleo de probióticos juntamente con la antibioterapia puede ser eficaz para aumentar los niveles de erradicación de la infección por H. pylori. Se requieren más estudios para realizar una recomendación firme relativa a su eficacia, dosis y tipo de probiótico en esta patología. En este sentido, la WGO(7) recoge en su guía sobre prebióticos y probióticos publicada en 2017 que ciertos probióticos como L. rhamnosus GG, B. clausii y S. boulardii pueden utilizarse eficazmente como terapia adyuvante para la erradicación del H. Pilory. También se ha observado dicha eficacia con la cepa L. reuteri DSM 17938 sola o combinada con L. reuteri ATCC 6475. El kéfir tomado dos veces al día también ha dado resultados positivos en este aspecto mejorando las tasas de erradicación en un 38%.
En un estudio doble ciego, un uso concomitante de Bacillus clausii (6×109/ d -1 vial 3 veces al día durante 14 días), en comparación con el placebo generaba una reducción significativa de la frecuencia y la intensidad de diarrea, náuseas, dolor epigástrico en pacientes que se sometieron a la erradicación de H. pylori con rabeprazol, amoxicilina y metronidazol durante 7 días. Otras cepas que han mostrado eficacia son B. lactis BB-12 y L. acidophilus LA-5, cepas que pueden y son utilizadas en procesos de obtención de yogur o leches fermentadas y que tomadas en dosis de 109 UFC, 1 o 2 veces al día ayudan a la erradicación de la bacteria como complemento al tratamiento con antibióticos.
En el Consenso de Maastrich V/Florencia de 2016(14) se apoya que los probióticos y los prebióticos son beneficiosos en la reducción de los efectos adversos del tratamiento erradicador de H. pylori y aumentan su tolerabilidad. Pueden ser especialmente útiles en los pacientes con infección por H. pylori refractaria a tratamientos previos o antecedentes de mala tolerancia gastrointestinal de los antibióticos. Otros ensayos sugieren que también esta suplementación puede ser eficaz para aumentar las tasas de erradicación, pero no hay evidencia que apoye la eficacia de un probiótico por sí solo, sin antibióticos concomitantes y hay resultados contradictorios en cuanto a la reducción de los efectos secundarios de la antibioterapia.
La guía clínica canadiense(5) y la recientemente publicada guía española(2,12) sobre suplementación con probióticos recoge también la eficacia de L. rhamnosus GG y S. boulardii y L. reuteri protectis DSM 17938.
Síndrome de intestino irritable (SII)
Debido a la ineficacia y a los efectos secundarios de algunos fármacos, tanto los pacientes como los profesionales de la salud, han buscado y continúan buscando, nuevos tratamientos con eficacia frente al SII. En este sentido, varios estudios han demostrado efectos beneficiosos en el uso de probióticos en lo que se refiere al alivio de los síntomas y por ese motivo, en los últimos años están surgiendo nuevos ensayos bien diseñados con buenos resultados de eficacia para mejorar la calidad de vida en pacientes con dolor abdominal funcional.
Hasta ahora, se sabe que los pacientes con SII presentan una microbiota distinta a la de los pacientes sanos. La evidencia científica muestra que la cepa Bifidobacterium longum 35624 es segura y que a dosis de 100 millones puede tener beneficios en la sintomatología pues en ensayos se asoció con una reducción significativa del dolor y el malestar, la hinchazón, distensión, flatulencia, urgencia defecatoria, la dificultad para defecar y sensación de evacuación incompleta y esfuerzo, con respecto a quienes recibieron el placebo.
En las Guías de la WGO(7,13) y otras refieren efectividad en este sentido de las siguientes cepas probióticas: B. longum infantis 35624; EscherichIa coli DSM 17252; la mezcla: L. plantarum (CECT 7484 y CECT 7485) y P. acidilactici (CECT 7483); L. plantarum 299v (DSM 9843); la mezcla: L. rhamnosus NCIMB 30174, L. plantarum NCIMB 30173, L. acidophilus NCIMB 30175, y E. faecium NCIMB 30176 y la levadura Saccharomyces boulardii CNCM I-745 entre otros.
En niños, también se ha encontrado eficacia demostrada para las cepas de L. reuteri protectis (DSM 17938) y L. rhamnosus GG (ATCC 53103) y la mezcla probiótica L. acidophilus SD5212 (DSM 24735), L. casei subsp. paracasei SD5218 (DSM 24733), L. delbrueckii subsp. bulgaricus SD5210 (DSM 24730), L. plantarum SD5209 (DSM 24730), B. longum SD5219 (DSM 24736), B. infantis SD5220 (DSM 24737), B. breve SD5206 (DSM 24732) y S. thermophilus SD5207 (DSM 24731).
Las revisiones más recientes están de acuerdo en que los probióticos disminuyen los síntomas.
La mayoría de los estudios sugieren que el Bifidobacterium, posiblemente las especies del Lactobacillus y E. coli DSM 17252, tienen beneficios en el tratamiento del SII. Varios ensayos clínicos usan la
combinación de probióticos (VSL#3) durante 5-6 meses demostrando que disminuyen las puntuaciones de síntomas totales (dolor abdominal, distensión, flatulencia y borborismos) de forma significativa.
Varios ensayos clínicos utilizan la combinación de probióticos durante 5-6 meses, demostrando que disminuyen el dolor abdominal, la flatulencia y los borborismos
También existen evidencias de que ciertos alimentos funcionales conteniendo probióticos, como es el caso de B. animalis DN-173 010 en una leche fermentada conteniendo también S. thermophilus y L. bulgaricus, pueden ejercer un efecto positivo en los síntomas de SII.
Gastroenteritis infecciosa aguda(7,15)
En el tratamiento de la gastroenteritis aguda en niños, sobre todo de etiología viral, las cepas Lactobacillus rhamnosus GG (LGG) o Saccharomyces (S) boulardii pueden considerarse como un complemento de la terapia de rehidratación oral. LGG debe administrarse durante 5-7 días, a una dosis ≥1010 UFC/día; y S. boulardii durante 5-7 días, a la dosis 250-750 mg/día. Si bien algunas de estas cepas mejoraron la duración media de la diarrea su nivel de evidencia fue bajo.
Otras cepas o productos que contienen cepas simples o múltiples de probióticos actualmente no tienen ninguna recomendación y para que sean realmente efectivos deberían iniciarse idealmente
temprano en el curso de la diarrea, su utilidad es máxima en GEA por rotavirus y ninguno ha demostrado ningún beneficio en la gastroenteritis de moderada a grave.
La AGA no recomienda el uso de probióticos en niños con gastroenteritis infecciosa aguda(13).
Malabsorción de lactosa
Está bastante establecido que los síntomas de intolerancia a la lactosa se manifiestan en menor medida al consumir yogur que leche. En este sentido, Streptococcus thermophilus y Lactobacillus delbrueckii subsp. Bulgaricus, que forman parte del cultivo iniciador del yogur, contribuyen a la digestión de la lactosa de forma eficiente al liberar la actividad β-galactosidasa en el intestino delgado. Esto se confirmó en una serie de estudios controlados con individuos que consumen yogur con cultivos vivos y existe evidencia sólida (nivel de evidencia 1) del efecto de estos microorganismos (al menos 108 UFC por gramo de producto y con una toma de una vez al día) en la mejora de la digestión de la lactosa y los síntomas asociados a la intolerancia a este disacárido. Tanto es así que está recogida así en la última revisión de la guía de la WGO(7,13) y es, por el momento, la única declaración de salud aceptada por el marco regulador de la CE.
En individuos con intolerancia a la lactosa, el uso de probióticos reduce los síntomas de inflamación o distensión, posiblemente como consecuencia de la presencia de la lactasa de las bacterias ácido-lácticas, mejorando así la digestión de la lactosa. Sin embargo, existe una amplia variedad en la actividad lactásica de los diferentes probióticos, lo cual, finalmente influye en su efecto. Se ha utilizado el
S. boulardii debido a su acción de estimular la actividad de las disacaridasas intestinales.
En los intolerantes a la lactosa, el uso de probióticos reduce los síntomas de inflamación y distensión, mejorando la digestión de la lactosa
Aparte de las especies del yogur, las cepas probióticas pertenecientes a otras especies son menos eficaces en el alivio de los síntomas de intolerancia a la lactosa, aunque Lactobacillus reuteri y L. acidophilus BG2FO4 han demostrado ser eficaces y pueden ser una opción terapéutica interesante en estos casos, ya que su uso es sencillo y su efecto puede durar en el tiempo después de suspender su administración.
Diarrea por antibióticos
En la WGO 2017(7), actualizada en 2020(13) con evidencia 1 incluye el uso de Saccharomyces boulardii CNCM I-745, 5 x 109 UFC/cápsula o 250-500 mg dos veces al día y el Lactobacillus rhamnosus GG a dosis de 1010 UFC/cápsula dos veces al día y con igual evidencia, además de estas y en adultos, se recomienda la combinación: L. acidophilus CL1285 y L. casei (Bio-K+ CL1285) ≥ 1010 UFC/día o Yogur con L. casei DN114, L. bulgaricus, y Streptococcus (S) thermophilus ≥ 1010 UFC/día para evitar la diarrea asociada al tratamiento con antibióticos y en la prevención de la diarrea asociada a Clostridium difficile. No se dispone de datos de seguridad sobre el uso de probióticos para la prevención de DAA en niños gravemente enfermos; por tanto, su uso debe estar sujeto a un escrutinio especial(15).
Actualmente, no se recomiendan otras cepas de probióticos, simples o combinadas.
Prevención de la diarrea del viajero
Es una variante del apartado anterior. En este caso se aportan mezclas de diversas cepas de forma profiláctica unos días antes y durante el viaje. Está especialmente indicado en el caso de viajeros internacionales a países tropicales. Es necesario llevar a cabo más estudios con otras cepas probióticas, dosis, tipos de paciente, agente causante de la diarrea, etc. que permitan demostrar su eficacia.
Prevención de la diarrea inducida por la radiación
La microbiota intestinal puede desempeñar un papel importante, reforzando la función de barrera intestinal, mejorando la inmunidad innata y estimulando los mecanismos de reparación intestinal.
Prevención diarrea nosocomial
La ESPGHAN (The European Society for Paediatric Gastroenterology Hepatology and Nutrition) recomienda que para prevenir la diarrea nosocomial se considere al LGG(9,15). Debe usarse a una dosis de, al menos, 109 UFC/día, mientras dure la estancia hospitalaria. No hay recomendaciones para prevenir las infecciones respiratorias de vías altas en niños hospitalizados. En WGO 2017(7), además de esta recomendación con evidencia 1, propone la combinación Bifidobacterium (B) lactis Bb12+S. thermophiles 108 + 107 UFC/g de fórmula en polvo con evidencia 2.
Infección por clostridium difficile
Las guías(2,4,5,10,13) respaldan el uso de ciertas formulaciones de probióticos para la prevención de la infección por Clostridioides difficile en adultos y niños que toman antibióticos. En una revisión se encontró un total de 76 ECA que utilizaron 44 cepas de probióticos diferentes o combinaciones de cepas.
La calidad general de la evidencia fue muy baja y no está confirmado cuales son las cepas más efectivas. En el resto de los estudios informaron algún beneficio, pero los tamaños de muestra fueron todos relativamente pequeños y tuvieron diferencias significativas en los sujetos y diseños del estudio.
En adultos y niños en tratamiento con antibióticos, la AGA recomienda el uso de S boulardii; o la combinación de 2 cepas de L acidophilus CL1285 y Lactobacillus casei LBC80R; o la combinación de 3 cepas de L. acidophilus, Lactobacillus delbrueckii subsp bulgaricus y Bifidobacterium bifidum; o la combinación de cepas de L acidophilus, L delbrueckii subsp bulgaricus, B bifidum y Streptococcus salivarius subsp thermophilus sobre ninguno u otros probióticos para la prevención de C. difficile infección(13).
El trasplante de microbiota fecal se ha demostrado eficaz para tratar la infección recurrente por C. difficile.
Salud bucodental(5)
Dado que las enfermedades orales son claramente polimicrobianas, las estrategias antibacterianas como las vacunas pueden no ser efectivas. Por ello, los tratamientos con prebióticos y probióticos encaminados a restablecer el equilibrio microbiano son las más prometedoras. En un estudio realizado con las cepas L. brevis CECT 7480 y L. plantarum CECT 7481 se demostró que estas poseen buenas propiedades como actividad antimicrobiana contra patógenos orales y podrían ser utilizadas para mejorar la salud oral.
Encefalopatía hepática(6,10)
La lactulosa, un disacárido prebiótico formado por unidades de fructosa y galactosa, se ha utilizado con éxito para la prevención, el tratamiento y es capaz de revertir una encefalopatía hepática mínima. También podría ser una opción terapéutica para la enfermedad hepática grasa no alcohólica. Ya ha sido probada en ensayos clínicos aleatorizados en adultos y niños y mejoraron los resultados del modelo de evaluación de la homeostasis, colesterolemia, factor de necrosis tumoral-α y pruebas de función hepática (alanina aminotransferasa o ALT y aspartato aminotransferasa o AST). Se necesitan más estudios para confirmar los beneficios a largo plazo.
La lactulosa se ha utilizado para la prevención, tratamiento y es capaz de revertir una encefalopatía hepática mínima
Enfermedad celiaca(2,4.5)
En los enfermos celiacos con enfermedad activa se ha demostrado, en biopsias duodenales, que hay una disbiosis intestinal con un aumento en el número total de bacterias Gram-negativas (Bacteroides y Escherichia coli) y con una menor proporción de bifidobacterias en comparación con aquellos sin sintomatología clínica. Los probióticos más estudiados son: Bifidobacterium lactis, Bifidobacterium longum, Lactobacilli, Propionibacterium y F. meningosepticum pero aún faltan estudios más concluyentes.
Estreñimiento funcional(2,5,12)
Existen numerosos estudios sobre la aplicación de los probióticos y prebióticos en pacientes con estreñimiento con resultados esperanzadores en el aumento del número de deposiciones y la disminución del dolor defecatorio. En adultos y niños la suplementación con Bifidobacterium lactis DN-173 010 ó Lactobacillus casei Shirota, ó Escherichia coli Nissle 1917 se ha comprobado que favorecen la frecuencia de las evacuaciones intestinales y la consistencia de las heces. Sin embargo, diferentes revisiones sistemáticas concluyeron que no hay evidencia suficiente para su recomendación rutinaria, por lo que se necesitan estudios de calidad para confirmar su efectividad.
Enfermedad diverticular(10)
En la no complicada, disminuye los síntomas abdominales y prolonga los periodos de remisión, pero no hay estudios aleatorizados.
Pancreatitis aguda
Los probióticos disminuyen la translocación bacteriana, disminuyen el riesgo de infección y abscesos pancreáticos en pacientes tratados, así como en paciente tratados con cepas inactivas.
Síndrome de intestino corto
En el caso del Síndrome de intestino corto y otras patologías intestinales existen pocos estudios en relación al tratamiento con probióticos, la mayoría de ellos experimentales.
Tablas y figuras
Tabla I: Funciones de la microbiota(1-5)
|
Función de inmunomodulación
|
- Activa los macrófagos locales y las células dendríticas para aumentar la presentación de antígenos a los linfocitos B
- Desencadena la producción de IgA secretora, tanto local como sistémica
- Modulan los perfiles de las citoquinas para desencadenar una respuesta tolerogénica (Th2) para permitir la supervivencia de la flora comensal o probiótica y la tolerancia a los alimentos
- Inducen una respuesta proinflamatoria (Th1) ante la presencia de patógenos
|
|
Función de barrera defensiva frente a patógenos
|
- Digiere los alimentos y compite con los patógenos por los nutrientes
- Modifica la actividad de enzimas intraluminales:
- Aumenta la actividad lactásica y de la glucosidasa
- Disminuye la actividad de otras enzimas como la b-glucoronidasa, la azorreductasa y la nitrorreductasa, que pueden estar implicadas en la síntesis y activación de carcinógenos
- Altera el pH local para crear un ambiente desfavorable para los patógenos
- Produce sustancias antibacterianas, como ácidos grasos volátiles, agua oxigenada o bacteriocinas, que eliminan e inhiben a los patógenos
- Fagocita radicales superóxidos
- Compite por los sitios de adhesión al moco y al epitelio intestinal, evitando la anidación y penetración de patógenos
- Estimula la producción epitelial de moco
- Aumenta la función de barrera intestinal mediante efectos antioxidantes y mejorando el trofismo epitelial, refuerza uniones estrechas, estimulando producción de moco por las células califormes
- Incrementa la secreción de péptidos antimicrobianos como las beta-defensinas por parte del enterocito
- Promueve la homeostasis intestinal de renovación y proliferación de enterocitos a través de rutas de señalización específicas, proteínas bacterianas que son capaces de estimular la fosforilación del EGF (Epidermal Growth Factors), promoviendo la supervivencia celular al inactivar vías proapoptóticas y estimular la proliferación celular
- Interviene en la angiogénesis intestinal
|
|
Función metabólica
|
- Produce fermentación de restos carbonados y proteicos no digeridos (almidón hemicelulosa, inulina, oligosacáridos, etc.)
- Dan AGCC: ácido acético, propiónico y butírico, también etanol y ácido láctico que regulan el metabolismo del colesterol
- Constituyen un aporte de energía extra para el organismo, y el colonocito favoreciendo el trofismo del mismo y la apoptosis tumoral
- Modifican el pH intestinal acidificándolo
- Favorecen la absorción de oligoelementos hierro, calcio y magnesio, y mejoran biodisponibilidad del zinc, cobre y fósforo
- Sintetiza vitaminas (la biotina, riboflavina, ácido pantoténico, piridoxina, cianocobalamina y vitamina K)
- Metabolizan sustancias tóxicas
|
|
Interacción microbiota- intestino-cerebral
|
|
La microbiota puede ejercer su efectos sobre el SNC a través de uno o varios mecanismos:
- Actuando directamente sobre el sistema nervioso entérico, encargado de controlar el aparato digestivo mediante la producción directa o la estimulación de neurotransmisores (serotonina, ácido gamma-aminobutírico, acetilcolina), que a su vez se comunica con el SNC
- Produciendo diferentes metabolitos, ácidos grasos de cadena corta y derivados que vía sistémica alteran o modulan la actividad tanto sistema neuro-endocrino como la barrera hematoencefálica alcanzando al cerebro
- Modulación del sistema inmunitario intestinal, a través de la producción citoquinas proinflamatorias o antiflamatorias que alcanzan la BHE y ejercen su función a nivel SNC 1
|
Tabla II. Conceptos y definiciones(1-5,11)
|
Microbiota
|
Colección de microorganismos (bacterias, hongos, arqueas, virus y parásitos) que pueblan un hábitat determinado. Pueden ser comensales, mutualistas o patógenos
|
|
Microbioma
|
Incluye los microorganismos, sus genomas y las condiciones ambientales presentes en el hábitat
|
|
Metagenoma
|
Colección de genomas y genes de los miembros de una microbiota
|
|
Metabolómica
|
Consiste en la identificación y caracterización de los metabolitos producidos por la microbiota desde un punto de vista funcional
|
|
Disbiosis
|
Desequilibrio en poblaciones y / o funciones de la microbiota, tanto por aumento o disminución o por cambios en número o variedad y que suponen una alteración estable de la composición, estructura o función de un nicho ecológico determinado con desaparición transitoria o definitiva de alguno de los efectos beneficiosos para la salud. Se puede acompañar de una respuesta inflamatoria, cronificarse y/o contribuir al desarrollo de enfermedad
|
|
Eubiosis
|
Es la microbiota, teóricamente “normal” y “equilibrada” y cumple presumiblemente todos los requisitos para que nos podamos beneficiar de sus efectos sobre la salud en un individuo sano
|
|
Prebióticos
|
Son sustancias de la dieta (polisacáridos u oligosacáridos no digeribles por enzimas humanas) que estimulan selectivamente el crecimiento o la actividad de bacterias a nivel gastrointestinal y beneficia la salud del huésped
|
|
Probióticos
|
Microorganismos vivos que, cuando se administran en cantidad adecuada, confiere beneficio para la salud al huésped con indicaciones precisas, seguridad y eficacia demostrada
|
|
Simbióticos
|
Cuando se usan probióticos y prebióticos de forma conjunta y se obtienen beneficios para la salud
|
|
Paraprobióticos
|
Probióticos muertos o no viables o inactivados con similares acciones y efectos que los vivos y pueden ser utilizados sin riesgos en pacientes más vulnerables
|
|
Postbióticos
|
Sustancias simples o complejas, producidos por el metabolismo de los probióticos con efectos beneficiosos sobre la salud similares a los mismos y sin riesgos al usarlos en pacientes comprometidos
|
|
Psicobióticos
|
Aquellos probióticos, prebióticos y otras estrategias que, al actuar sobre el eje microbiota-intestino-cerebro, pueden conferir beneficios para la salud mental
|
|
Nutracéuticos o biocéutico
|
Es un producto presentado como una alternativa farmacéutica que dice tener efectos beneficiosos. Incluye a todos los anteriores
|
Tabla III. Indicaciones en pediatría de probióticos con nivel de evidencia 1 y 2
|
INDICACIÓN Y CEPAS
|
|
RECOMENDACIÓN DE GRADO A (Datos de nivel 1A)
|
- Tratamiento de la diarrea infecciosa aguda en niños
- Prevención de la diarrea asociada a los antibióticos
- Prevención de la diarrea nosocomial y adquirida en niños
- Diarrea en niños
- Tratamiento de la malabsorción de lactosa
|
|
RECOMENDACIÓN DE GRADO A (Datos de nivel 1B)
|
- Prevención de la infecciones del postoperatorio
- Prevención y gestión de las enfermedades atópicas pediátricas
|
|
RECOMENDACIÓN DE GRADO B (Datos de nivel 2B)
|
- Prevención de la diarrea del viajero
- Prevención de la sepsis asociada a la pancreatitis aguda
- Mantenimiento de la remisión de la colitis ulcerosa
- Reducción del colesterol en sangre
|
Guía Práctica de la Organización Mundial de Gastroenterología: probióticos y prebióticos. Febrero 2017.WGO, 2017(7)
Bibliografía
**1. Hernández Hdez A, Coronel Rodríguez C, Monge Zamorano M, Quintana Herrera C. Microbiota, Probióticos, Prebió ticos y Simbióticos. Pediatr Integral 2015; XIX (5): 337-354.
**2. Hernández Hdez A, Coronel Rodríguez C, Gil Vázquez JM. Novedades en probióticos: evidencias, indicaciones y seguridad. Pediatr Integral 2020; XXIV (3): 151 – 165.
3. del Campo-Moreno R, Alarcón-Cavero T, D’Auria G, Delgado-Palacio S y Ferrer-Martínez M. Microbiota en la salud humana: técnicas de caracterización y transferencia. Enferm Infecc Microbiol Clin. 2018;36 (4):241–245.https://doi.org/10.1016/j.eimc.2017.02.007.
4. Anales de Microbiota, Probióticos, Prebióticos. Volumen 1 • Número 1 • 2020 XI Workshop Sociedad Española de Microbiota, Probióticos y Prebióticos Granada, 12-14 febrero 2020 ISSN: 2695-6837.
5. Álvarez Calatayud G, Mateos Lardiés AM. Guía de actuación y documento de consenso sobre el manejo de preparados con probióticos y/o prebióticos en la farmacia comunitaria SEFAC-SEPyP 1a edición, febrero de 2018 ISBN: 978-84-09-01961-8.
6. Castillo-Álvarez F, Marzo-Sola ME. Papel de la microbiota intestinal en el desarrollo de diferentes enfermedades neuro lógicas. Neurología. 2019. https://doi.org/10.1016/j.nrl.2019.03.017.
**7 Guarner F, Sanders ME, Eliakim R, Fedorak R, Gangl A, Garisch J, et al. World Gastroenterology Organisation Global Guidelines. Probiotics and prebiotics 2017. Acceso el 1 de diciembre de 2019. Disponible en: http://www.worldgastroenterology.org/guidelines/global-guidelines/probiotics-and-prebiotics.
8. Fiocchi A, Pawankar R, Cuello‐Garcia C, Ahn K, Al‐Hammadi S, Agarwal A, et al. World Allergy Organization-McMaster University Guidelines for Allergic Disease Prevention (GLAD-P): World Allergy Organization J. 2015; 8: 4.
9. Espín Jaime B. Recomendaciones y evidencias sobre el uso racional de probióticos en Pediatría. Form Act Pediatr Aten Prim. 2019;12(4):213-7.
10. Castañeda Guillot C. Probióticos, puesta al día. Revista Cubana de Pediatría. 2018;90(2):286 – 298.
11. Requena T, Velasco M. Microbioma humano en la salud y la enfermedad. Rev Clin Esp. 2019. https://doi.org/10.1016/j.rce.2019.07.004.
12. Fernández N, Cardelle-Cobas A, Regal P, Cepeda A, Fente C. Primera guía clínica basada en la evidencia médica para la suplementación con probióticos en la farmacia comunitaria española. Farmacéuticos Comunitarios. 2017 Mar 30; 9(1):14-27. https://doi.org/10.5672/FC.2173-9218.(2017/Vol9).001.03.
13. Su LG, Ko CW, Bercik P, Ytter YF, Sultan S, Weizman AV, Morgan RL: AGA Clinical Practice Guidelines on Probiotics and Gastrointestinal Disorders. Gastroenterology 2020;159:697–705.
14. Malfertheiner P, Megraud F, O’Morain CA, Gisbert JP, Kuipers EJ, Axon AT, et al. Management of Helicobacter pylori infection-the Maastricht V/Florence Consensus Report Intestino. 2017; 66: 6-30.
15. Hojsak I, Fabiano V, Pop TL, Goulet O, Zuccotti GV, Cullu F, et al. Guidance on the use of probiotics in clinical practice in children with selected clinical conditions and in specific vulnerable groups. Acta Paediatr. 2018; 107: 927-37.