Estado actual de las vacunas frente a la COVID-19
Estado actual de las vacunas frente a la COVID-19
R. Ortiz de Lejarazu Leonardo, I. Sanz Muñoz.
Centro Nacional de Gripe de Valladolid.
Fecha de recepción: 26-02-2021
Fecha de publicación: 28-02-2021
Adolescere 2021; IX (1): 90-101
Resumen
|
La situación actual de pandemia de COVID-19 concede a la Pediatría un periodo de reflexión y aprendizaje, respecto a las vacunas y la vacunación COVID-19, del que desgraciadamente no disponen el resto de especialidades de los adultos. No existen precedentes en los esfuerzos que se han realizado, ni el corto espacio de tiempo en el que se han diseñado, fabricado, testado y distribuido los nuevos diseños vacunales frente a esta nueva enfermedad. En este artículo se expone la clasificación epidemiológica e histórica de las especies de coronavirus humanos, las características peculiares de la infección por COVID-19 en la población infantojuvenil, la evolución de la tecnología en la producción de vacunas desde las clásicas hasta las de última generación. Entre ellas destacan las vacunas RNA, vacunas basadas en vectores virales, vacunas de virus inactivados y vacunas de subunidades proteicas. Todas estas vacunas utilizan como antígeno la proteína de la espícula S (Spike S) del coronavirus. Se detallan las vacunas frente al COVID-19 según su diseño, funcionamiento, pauta de administración, edad, seguridad y eficacia. Por último, se comentan las nuevas variantes del virus y los escenarios futuros en la vacunación. Palabras clave: Vacunas; SARS-CoV-2; COVID 19; Vacunas RNAm; Vacunas vector viral. |
Abstract
|
The current COVID-19 pandemic situation unfortunately represents a period of reflection and learning for Pediatrics regarding vaccines and COVID-19 immunization, to which the adult specialties remain oblivious. There are no precedents in the efforts that have been made, nor the short space of time in which new vaccines have been designed, manufactured, tested and distributed against this new disease. This article includes the epidemiological and historical classification of human coronavirus species, the particular characteristics of COVID-19 infection in child and adolescent population, the progress of technology in the production of vaccines ranging from the classical to the latest generation. These include RNA vaccines, vaccines based on viral vectors, inactivated virus vaccines and protein subunit vaccines. All these vaccines use the spike S protein of the coronavirus as antigen. The vaccines against COVID-19 are explained in terms of design, mechanism of action, administration schedule, age, safety and efficacy. Lastly, new variants of the virus and future vaccination scenarios are discussed. Key words: Vaccines; SARS-CoV-2; COVID 19; RNAm vaccines; Viral vector vaccines |
Introducción
El especialista en Pediatría que se asome a este artículo puede pensar que la población infantil, y en consecuencia los pediatras, son los que menos van a resultar afectados en estos momentos por el tema planteado en esta revisión. Y efectivamente es así; pero esta situación en la pandemia de COVID-19 concede a la Pediatría un periodo de reflexión y aprendizaje, respecto a las vacunas y la vacunación COVID-19, del que desgraciadamente no disponen el resto de especialidades de los adultos, enfrentadas hoy a hoz y coz a la urgencia de vacunar a la mayor cantidad de personas posibles en el menor espacio de tiempo, en un horizonte de escasez de vacunas, donde además se avistan estrategias de pautas de administración y de dianas de población que difieren notablemente.
La pandemia de COVID-19 concede a la Pediatría un periodo de reflexión y aprendizaje, respecto a las vacunas y la vacunación COVID-19, del que desgraciadamente no disponen el resto de especialidades de los adultos
Sin ir más lejos, en Europa ya existe la controversia sobre la aplicación de una sola dosis para lograr una mayor protección colectiva en el más corto tiempo posible; adoptada por el Reino Unido (UK), que prefiere tener el doble de población con una protección inferior a la máxima alcanzable que, con una segunda dosis, tener a la mitad de población con el máximo de protección posible. El debate se ha trasladado a EE.UU., país que comparte con UK una gestión alternante de la pandemia con resultados en algunos momentos devastadores. Sin embargo, ambos países tienen en común que son productores de vacunas, lo que les sitúa, frente a otros países no productores, en una posición ventajosa a la hora de elegir diferentes estrategias de vacunación.
La enfermedad por coronavirus 2019 (COVID-19) es una enfermedad causada por el virus SARS-CoV-2, un virus cubierto con RNA monocatenario, rodeado de grandes espículas en su superficie que le dan aspecto de corona o halo solar, origen etimológico de su nombre (Figura 1). Pertenece al subgénero Sarbecovirus (etimológicamente, de SARs beta coronavirus) relacionado con el desaparecido virus del SARS (SARS-CoV-1). En ese grupo no hay ningún otro coronavirus humano, pero entre los Betacoronavirus existen otros coronavirus endémicos humanos como el OC43 y el HKU1 que forman parte de otro subgénero de los Betacoronavirus denominado Merbecovirus (de MERS beta coronavirus). Todos ellos comparten epítopos antigénicos comunes en mayor o menor medida con el de la COVID-19, siendo más próximos los de los betacoronavirus antes citados, que los alfacoronavirus humanos endémicos (HCoV 229E y NL63) más alejados filogenéticamente (Figura 2). Todos ellos producen infecciones respiratorias generalmente de tipo catarral, aunque en alguno de ellos (HKU1) su descubrimiento se hizo a partir de casos de neumonía grave. Se estima que en conjunto son responsables de un 10-25% de los síndromes catarrales con una estacionalidad marcada en otoño/invierno.
Se estima que los coronavirus, en conjunto, son responsables de un 10-25% de los síndromes catarrales con una estacionalidad marcada en otoño/invierno
Aspectos peculiares de la infección COVID-19 en niños
En todo el mundo, se han reportado menos casos de COVID-19 en niños que en adultos. La mayoría de los casos en niños son leves y el tratamiento es sintomático y de apoyo. Los niños representan el 12,4% de todos los casos declarados en España y sucede algo similar en el resto de países. En los datos de vigilancia en Europa, entre los casos de COVID-19 pediátricos, los niños entre 1 y 18 años de edad tienen tasas más bajas de hospitalización, de hospitalización por enfermedad grave y de muerte que todos los demás grupos de edad. Las razones de este fenómeno no están completamente establecidas y entre ellas se han esgrimido la menor densidad de receptores ACE2, la existencia de un sistema de respuesta innata menos proclive al daño inflamatorio, mayor población de células naive de respuesta inmune, infecciones recientes por otros coronavirus endémicos e incluso la existencia de una microbiota peculiar de la infancia, la “interferencia vírica” de otras infecciones víricas de la infancia o una “respuesta inmune entrenada” por la concurrencia de numerosas vacunaciones en el periodo infantil.
Al no existir ninguna vacuna COVID-19 aprobada para menores de 16 años, los cierres de guarderías, colegios e institutos han sido objeto de intenso debate entre las medidas de distanciamiento social por restricción de eventos masivos. Existe un consenso general de que la decisión de cerrar las escuelas para controlar la pandemia de COVID-19 debe utilizarse como último recurso. El impacto negativo en la salud física, mental y educativa de los cierres de escuelas en los niños, así como el impacto económico en la sociedad en general, probablemente superarían los beneficios de esas medidas que se han adoptado de forma desigual a lo largo de Europa(1). Los niños de todas las edades son susceptibles al SARS-CoV-2 y pueden transmitirlo a otros. Los niños más pequeños parecen ser menos susceptibles a la infección y cuando se infectan, protagonizan menos frecuentemente una transmisión tan eficaz como los adolescentes y los adultos(2).
El impacto negativo en la salud física, mental y educativa de los cierres de escuelas en los niños, así como el impacto económico en la sociedad en general, probablemente superarían los beneficios de esas medidas que se han adoptado de forma desigual a lo largo de Europa
Los cierres de escuelas pueden contribuir a una reducción de la transmisión del SARS-CoV-2, pero por sí mismos son insuficientes para prevenir la transmisión comunitaria del COVID-19 en ausencia de otras intervenciones no farmacéuticas (NPI) como son las restricciones de reuniones masivas y las restantes de índole individual. Por ello desde la aparición de las vacunas muchos pediatras reclaman la realización de ensayos de seguridad, inmunogenicidad y eficacia para la población pediátrica que permitan establecer programas específicos de vacunación a esta población tan especial, lo que sin duda reducirá ansiedad y dudas entre padres, maestros y cuidadores con estándares máximos de seguridad y eficacia(3).
Evolución de la tecnología de producción de vacunas
Las vacunas actuales se pueden clasificar en dos grandes grupos según la antigüedad de la tecnología de producción que utilicen. Por un lado, las vacunas clásicas son las más frecuentemente utilizadas en el ser humano y utilizan tecnologías de producción más rudimentarias. Por otro lado, las vacunas de nueva generación utilizan tecnología más vanguardista, y en muchos casos basada en métodos moleculares con el fin de aumentar la eficacia de la respuesta protectora que induce. A continuación, se describen brevemente los tipos de vacunas existentes:
Vacunas clásicas
- Vivas atenuadas
Son vacunas de virus vivos completos a los que se les ha desprovisto de patogenicidad por distintos mecanismos (cultivo en células semipermisivas, pases en animales, rutas de inoculación distinta a la natural, etc.). Fueron las primeras en desarrollarse. La mayoría de vacunas clásicas anteriores al siglo XX o de principios y mediados de él, responden a ese concepto. Hoy sería imposible desarrollarlas por motivos éticos. Actualmente se sustituyen ciertos genes virales responsables de la patogenicidad por otros procedentes de cepas del mismo virus que son avirulentas, manteniendo presentes en la estructura del virión el resto de proteínas de interés que actúan como epítopos antigénicos protectores. Estos genes internos avirulentos eliminan la capacidad del virus de causar enfermedad, pero no limitan su replicación, por lo que la vacunación produce una respuesta muy completa, tanto a nivel humoral como celular.
La vacunas vivas atenuadas son vacunas de virus vivos completos a los que se les ha desprovisto de patogenicidad por distintos mecanismos
- Vivas inactivadas
En las vacunas vivas inactivadas, la inmunogenicidad es elevada pero también la reactogenicidad
Utilizan virus completos pero inactivados (muertos) por diversos métodos (β-propiolactona, UV, etc.). Mantienen con cierta integridad las propiedades de la estructura del virión y de los antígenos/epítopos protectores de interés. La inmunogenicidad es elevada pero también la reactogenicidad.
- Vacunas de subunidades o fraccionadas
En algunos casos, el microorganismo se fracciona en sus diferentes componentes mediante procedimientos físico-químicos, y después se estandariza la dosificación en función de los antígenos deseados. Al tratarse de virus fraccionados, la reactogenicidad disminuye con respecto a las vacunas de virus completos, pero también la inmunogenicidad.
- Vacunas de antígenos purificados
Para algunos tipos de vacunas es relevante que esté presente un solo tipo de antígeno protector.
En estas, tras el fraccionamiento del virus, se realizan diferentes procesos de purificación para eliminar el resto de componentes indeseados (material genético viral, otras proteínas, etc.), y la dosis se estandariza con respecto a la cantidad concreta de dicho antígeno.
- Vacunas adyuvadas
Una variación de las vacunas de subunidades y de las de antígenos purificados consiste en incluir productos adyuvantes (como el MF59, AS03, AF03, etc.), que refuerzan o potencian la inmunización a través de la exposición más prolongada del antígeno al sistema inmune, o facilitar su vehiculización o la presentación del antígeno. Una de las ventajas de los adyuvantes es que permiten reducir la cantidad de antígeno, asegurando la misma o mayor efectividad, lo que permitir aumentar la producción de dosis de vacunas con menor cantidad de antígeno.
Algunas vacunas contienen productos adyuvantes que refuerzan o potencian la inmunidad
- Vacunas de partículas similares a virus (VLPs)
Las vacunas de VLPs o Virus Like Particles (Partículas Similares a Virus) son estructuras pseudovirales o carcasas en las que se acoplan las proteínas o antígenos de interés del virus frente al que se desea vacunar. Estas VLPs están vacías, por lo que son completamente seguras ya que son estructuras inertes (son solo un armazón biológico) en las que se acoplan los antígenos protectores para dotarles de mayor inmunodominancia. Sin embargo, al tener una disposición parecida a la natural en el virus salvaje, la inmunogenicidad es mayor, pero sin el inconveniente de la reactogenicidad de las vacunas de virus completos.
Las vacunas de VLPs (Partículas Similares a Virus) son estructuras pseudovirales o carcasas en las que se acoplan las proteínas o antígenos de interés del virus frente al que se desea vacunar
Vacunas de última generación
- Vacunas basadas en péptidos
Las vacunas que utilizan péptidos se basan en la administración de secuencias aminoacídicas cortas que se corresponden con los epítopos antigénicos de interés. Deben ser lo más conservados e inmunógenos posibles. Los péptidos deben ser de aproximadamente 8-10 aminoácidos para activar las células T (inmunidad celular, Th1) y de no más de 20 aminoácidos para activar también la respuesta de células B (inmunidad humoral, Th2).
- Vacunas de proteínas recombinantes
Estas vacunas se fabrican utilizando vectores víricos que transfectan (transportan al interior de células) el gen del antígeno protector del virus objeto de la vacuna, al interior de una célula viva. La célula será infectada por el vector viral, y tras la transcripción del gen del antígeno y su posterior traducción a proteína, la célula liberará o mostrará el antígeno en su superficie que podrá ser extraído posteriormente. Este antígeno tendrá la forma nativa y podrá producirse sin necesidad del cultivo tradicional del virus. Normalmente se usan biorreactores celulares con células vivas en crecimiento continuo.
- Vacunas de vectores virales
Las vacunas de vectores virales son una modificación de las vacunas DNA y RNA. Estas vacunas se producen incluyendo en un vector viral, comúnmente adenovirus animales o humanos poco frecuentes (vectores adenovirales), el fragmento de material genético que codifica el antígeno de interés.
De esta forma, el vector viral infectará la célula sin causar ninguna enfermedad, y al entrar en su interior liberará el material genético codificante del antígeno de interés. Tras esto, y de forma similar a las vacunas DNA y RNA, comenzará la transcripción y traducción a proteínas y la posterior respuesta celular y humoral tras la presentación antigénica. Los vectores pueden ser replicativos cuando se multiplican tras la entrada en la célula amplificando la expresión de DNA o RNA y consiguientemente del antígeno codificado o no replicativos en los que solo se trasfiere la copia.
Algunas vacunas se producen incluyendo en un vector viral, comúnmente adenovirus animales o humanos poco frecuentes, el fragmento de material genético que codifica el antígeno de interés
- Vacunas DNA
Para la producción de estas vacunas se clona (se identifica, se aísla y se inserta) el fragmento de DNA que codifica el antígeno de interés en un plásmido, y después se administra mediante inyección al sujeto a vacunar transportándolo de diversas maneras. De esta forma, las células del hospedador capturarán este plásmido, y será presentado a las células presentadoras de antígeno, que comenzarán a producir el antígeno y activarán diferentes rutas de señalización celular para inducir la producción de anticuerpos y la respuesta celular mediada por células T.
En las vacunas DNA se clona el fragmento de DNA que codifica el antígeno de interés en un plásmido, y después se administra mediante inyección al sujeto a vacunar
- Vacunas RNA
De un modo similar a las vacunas DNA, el objetivo de las vacunas RNA es introducir material genético codificante del antígeno vírico de interés, y que la célula receptora produzca su expresión a proteína para activar tanto la respuesta humoral como la celular. La principal diferencia con las vacunas DNA es que el RNA, al ser una molécula mucho más inestable y frágil, debe ser protegido por diversos métodos moleculares para evitar su degradación por endonucleasas celulares, por lo que la vehiculización es más compleja. Al igual que los vectores puede ser RNA auto replicativo o no replicativo.
El objetivo de las vacunas RNA es introducir material genético codificante del antígeno vírico de interés, y que la célula receptora produzca su expresión a proteína para activar tanto la respuesta humoral como la celular
Principales vacunas frente a la COVID-19
La carrera por obtener vacunas eficaces frente a la COVID-19 ha tenido como consecuencia que ciertas tecnologías vacunales que aún no se habían empleado para la producción de vacunas frente a enfermedades humanas, hayan dado el salto definitivo y el espaldarazo científico de poder ser probadas, testadas y utilizadas. Esto ha supuesto un hito y un salto cualitativo en la historia de las vacunas.
No existen precedentes en los esfuerzos que se han realizado, ni el corto espacio de tiempo en el que se han diseñado, fabricado, testado y distribuido los nuevos diseños vacunales frente a esta nueva enfermedad, sino hubiera sido por los avances en las últimas dos décadas de este siglo en otras vacunas animales y experimentales con dichas plataformas de producción.
En el mes de febrero del año 2021, existían 73 diseños vacunales en desarrollo clínico, y 182 en desarrollo pre-clínico frente a la COVID-19 (Tabla I)(4).
No existen precedentes en los esfuerzos que se han realizado, ni el corto espacio de tiempo en el que se han diseñado, fabricado, testado y distribuido los nuevos diseños vacunales frente a esta nueva enfermedad
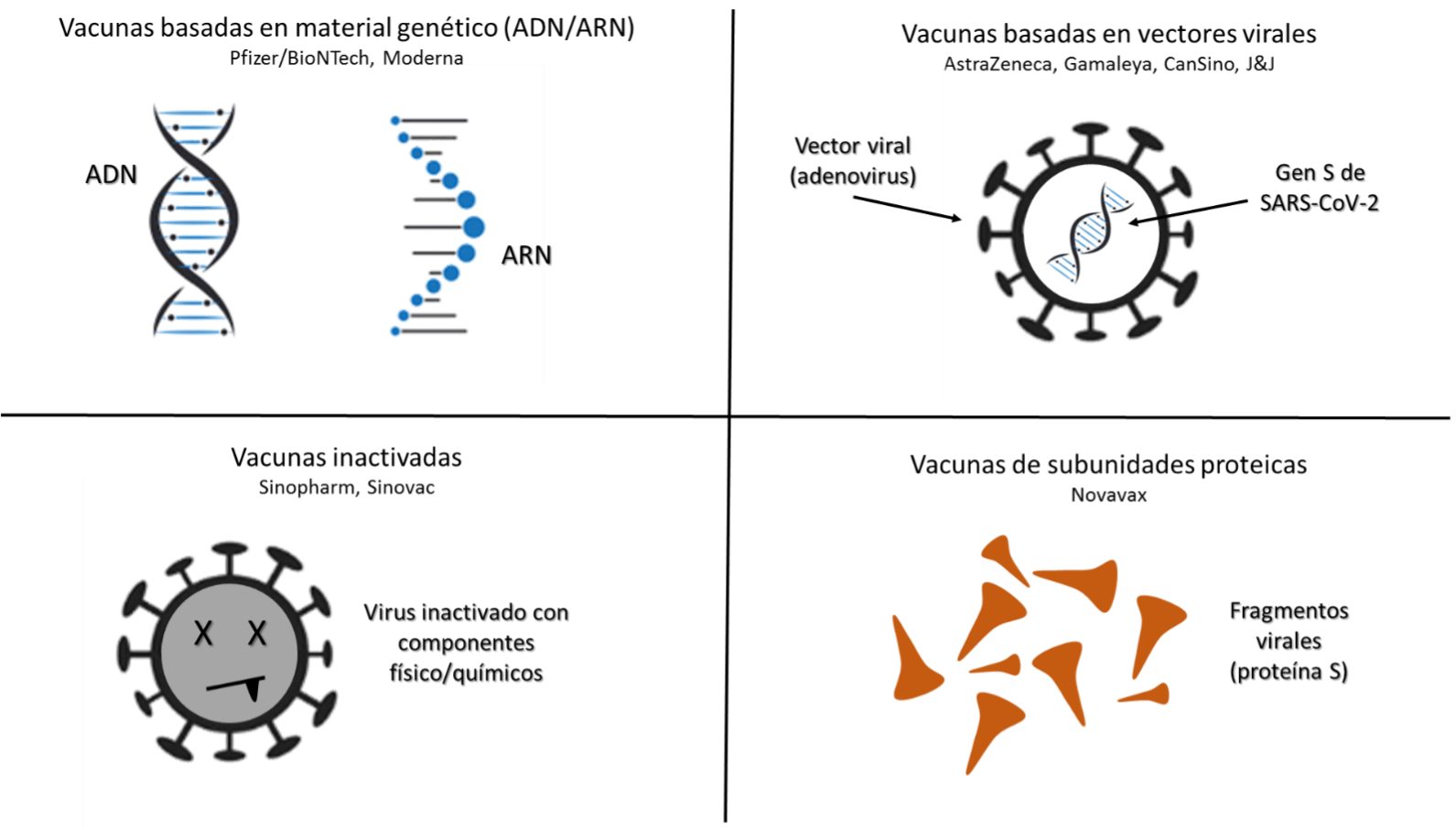
La tecnología de desarrollo que se está utilizando para el diseño de las vacunas frente a la COVID-19 es variada, y si bien muchos diseños incluyen vacunas clásicas, una buena parte de los grupos de investigación se han aventurado a explorar tecnologías de nueva generación. Entre ellas destacan las vacunas RNA, vacunas basadas en vectores virales, vacunas de virus inactivados y vacunas de subunidades proteicas, entre otras (Figura 3).
A continuación, se describen en detalle su funcionamiento y los diseños llevados a cabo por la industria en este campo:
- Vacunas RNA
Las vacunas RNA consisten en un fragmento de RNA mensajero (RNAm) que codifica el antígeno de interés, y que es transportado mediante la inyección en el sujeto vacunado hasta las células. Este RNAm, que puede ser vehiculizado mediante diferentes sistemas (como nanopartículas lipídicas) para protegerlo, es capturado por una célula y a través de los ribosomas comenzará su traducción a la proteína de interés. Tras la construcción de este antígeno, existen varios caminos a través de los cuales se induce la respuesta inmunitaria. El primero de ellos es la liberación del antígeno por la célula al espacio extracelular. A través de este sistema, el antígeno liberado podrá ser reconocido por células presentadoras de antígeno u otras células inmunitarias. Este antígeno, al ser endocitado por estas células, activará el Complejo Mayor de Histocompatibilidad de tipo II (MHC-II) que activará la respuesta humoral a través de linfocitos CD4+. En tercer lugar, si el antígeno no sale de la célula y es metabolizado por el proteosoma, los péptidos resultantes se pueden unir al MHC-I y por vía del aparato de Golgi y posterior localización en la membrana celular, activar la respuesta celular a través de linfocitos CD8+.
La ventaja de este sistema es que simula prácticamente a la perfección lo que ocurre en una célula cuando se infecta con un virus, por lo que la respuesta es muy completa (celular y humoral), activando gran cantidad de células del sistema inmune. Por un lado, los linfocitos T-citotóxicos eliminan las células infectadas con el virus, mientras que los anticuerpos son capaces de neutralizarlo. Esta acción coordinada es más útil que las vacunas que solo producen anticuerpos. En algunos diseños, dentro del gen transportado hay una región que codifica para un complejo polimerasa, comúnmente derivado de un Alfavirus (denominado como repRNA)(5). Esto permite que el RNA se amplifique dentro de la célula y de lugar una respuesta inmunológica más duradera tanto a nivel humoral como celular(6).
La ventaja del mecanismo de acción de las vacunas RNA, es que simula prácticamente a la perfección lo que ocurre en una célula cuando se infecta con un virus, por lo que la respuesta es muy completa (celular y humoral), activando gran cantidad de células del sistema inmune
Durante las primeras fases de la vacunación de la pandemia de COVID-19, las dos primeras vacunas aprobadas por organismos internacionales regulatorios para su utilización en seres humanos fueron precisamente vacunas RNA, en concreto las vacuna BNT162b2 de Pfizer/BioNTech, y la vacuna mRNA-1273 de Moderna/NIAID. Tanto una como la otra tienen como diana la proteína S del virus, que es la llave de entrada del virus a la célula. Existen otros diseños de vacunas RNA pero en fases experimentales menos avanzadas, la más avanzada es la de CureVac AG (fase III), de CVnCOV, y LNP-nCoVsaRNA del Imperial Collegue de Londres (fase I), entre otras.
Tanto las vacunas de Pfizer/BioNTech como Moderna/NIAID mostraron valores de eficacia superiores al 95% en los ensayos clínicos en fase III
Tanto las vacunas de Pfizer/BioNTech como Moderna/NIAID mostraron valores de eficacia superiores al 95% en los ensayos clínicos en fase III(7,8). La efectividad se ha podido ir comprobando en el periodo de uso cuando, en países como Israel, ha disminuido drásticamente la mortalidad debida a la COVID-19 en mayores de 65 años tras la administración de las dos dosis en este grupo poblacional(9).
- Vacunas basadas en vectores virales
Las vacunas basadas en vectores virales utilizan un principio muy similar a las vacunas de tipo RNA.
Se basan igualmente en la producción dentro de las células humanas de un antígeno a partir de material genético (DNA de cadena doble o RNA) que se suministra a través de la vacuna. Sin embargo, aquí dicho material genético es transportado por un virus donador, una carcasa de otra especie vírica (diferente al SARS-CoV-2) cuya misión es internalizar dicho material de interés en la célula. En el diseño de este tipo de vacunas se utilizan muchos vectores diferentes, que son otros virus como el de la estomatitis vesicular, el sarampión, o los más frecuentemente utilizados que son los adenovirus. El gen diana para codificar el antígeno que genere inmunidad frente al SARS-CoV-2 se inserta dentro de un virus vector, que lo transportará hasta la célula diana, donde se libera y comienza a traducirse a proteína.
Una de las limitaciones de las vacunas basadas en vectores virales es que el sujeto vacunado puede tener algún tipo de inmunidad pre-existente frente al vector, y por lo tanto limitar la efectividad de la misma
Una de las principales limitaciones de este tipo de vacunas es que el sujeto vacunado puede tener algún tipo de inmunidad pre-existente frente al vector, y por lo tanto limitar la efectividad de la misma al neutralizar al vector antes de penetrar en las células diana. Para solventar esto, frente a la COVID-19 se han utilizado vectores como adenovirus de chimpancé (Oxford/AstraZeneca; ChAdOx1 nCoV-19 – 63,1% efectividad fase III)(10), adenovirus con poca prevalencia en el ser humano como los AD26 y AD5 (Instituto Gamaleya; Sputnik V – 91,6% efectividad fase III)(11), AD26 (JNJ-78436735; Johnson&Johnson – 85% efectividad en fase I-IIa)(12), y AD5 (AD5-nCoV; CanSino Biologicals)(13). Este tipo de vectores virales están modificados genéticamente para que puedan entrar en las células, pero no replicarse ni causar enfermedad. Únicamente transportan el material genético de interés del SARS-CoV-2 como una suerte de nave de carga.
Los vectores virales están modificados genéticamente para que puedan entrar en las células, pero no replicarse ni causar enfermedad. Solo transportan el material genético
Utilizar dos vectores virales diferentes para las vacunas que requieren doble dosis (Sputnik V, Gamaleya) es una aproximación conceptualmente interesante que persigue evitar el efecto de posibles anticuerpos generados contra el vector en la primera dosis que puedan bloquear ese mismo vector vírico en la segunda dosis. En las vacunas que utilizan el mismo vector viral para ambas dosis, a veces, tras la primera inmunización, se genera una respuesta no solo frente al antígeno de interés del SARS-CoV-2, si no también frente a la carcasa o vector viral que lo transporta. Esto puede ser causa de que al aplicar la segunda dosis se neutralice parte de los vectores virales. Si se genera una respuesta frente a este vector en la primera dosis, tras la segunda dosis el sistema inmune puede reconocerlo y eliminarlo, por lo que las dosis de recuerdo podrían generar menor aumento de la protección que si se utilizara un vector viral diferente al de la primera dosis.
Para resolver estas limitaciones se utilizan adenovirus de chimpancé y adenovirus con poca prevalencia en el ser humano y también vectores virales diferentes para las vacunas que requieren
doble dosis
Una de las principales ventajas de las vacunas de vector viral con respecto a las vacunas RNA es que, al transportarse el material genético en una carcasa viral, este se mantiene mucho mejor que el que se transporta mediante nanoparticulas lipídicas, y por tanto no requiere para su estabilidad temperaturas de congelación tan bajas. Muchas de estas vacunas de vectores están compuestas por DNA bicatenario, una molécula mucho más estable que el RNA monocatenario, que aumenta también la estabilidad biológica de la vacuna.
- Vacunas de virus inactivados
Este tipo de vacunas utilizan versiones inactivadas del SARS-CoV-2 (por medios físicos, químicos, o ambos), de manera que el sistema inmune reconoce el virión completo, pero este es incapaz de infectar las células ni producir enfermedad. Este tipo de vacunas clásicas producen una respuesta inmunitaria muy completa, tanto celular como humoral, al exponer el virión entero. Para producir los viriones completos para estas vacunas, se cultiva el virus en células VERO (células de riñón de mono verde), que es una línea celular en las que el virus es capaz de crecer eficazmente.
Aunque su inmunogenicidad es de espectro más amplio, los títulos de anticuerpos alcanzados pueden ser menores que con las de RNA y la reactogenicidad puede ser mayor que las de subunidades.
Sin embargo, tienen otras ventajas como que son las de tecnología de producción más sencilla, por lo que pueden ser una buena opción para situaciones de demanda aumentada y para países de potencial medio de desarrollo científico. Muchas de estas vacunas están formuladas con diversos adyuvantes como el hidróxido de aluminio y el VLA-2001, entre otros(14). Algunas de las vacunas de este tipo, como la de SinoVac BioTech o la de Wuhan Institute of Biological Products (SinoPharm) y Beijing Institute of Biological Products, muestran valores de efectividad en fase clínica III en torno al 65-85%(4).
- Vacunas de subunidades proteicas
Las vacunas de subunidades proteicas son las que mayor número representan dentro de los diseños vacunales que se están explorando frente a la COVID-19 (más del 32%; Tabla I). Esto probablemente se deba a que es una tecnología vacunal muy explorada, que no poseen componentes vivos y por tanto muy seguras. Sin embargo, se requieren de métodos complejos para su fabricación, y debido a su naturaleza suelen requerir de adyuvantes para potenciar su efecto. Es frecuente que la producción de este tipo de vacunas se lleve a cabo mediante la expresión de una proteína recombinante de interés en un cultivo celular, mediante su transportación o transfección a través de baculovirus. Por ello algunas se denominan recombinantes.
Muchos de los diseños basados en esta tecnología frente la COVID-19 usan preferentemente el sitio de unión al receptor o RBD (Receptor Binding Domain) de la subunidad S1, aunque otros expresan la proteína S completa o solo la subunidad S1. La vacuna más avanzada basada en esta tecnología es la de Novavax, que contaba con un 89,3% de efectividad en los ensayos en fase III(15). En la tabla II se muestran las principales vacunas frente a la COVID-19 descritas y aspectos relevantes sobre las mismas.
La vacuna más avanzada en la actualidad basada en subunidades proteicas es la de Novavax, que contaba con un 89,3% de efectividad en los ensayos en fase III
Escenarios futuros en la vacunación COVID-19
Dos aspectos son fundamentales a la hora de anticipar diferentes escenarios en una difusión pandémica a partir de la aparición de vacunas eficaces frente a una infección respiratoria de escasa gravedad e incidencia en niños y adolescentes. El primero de ellos será la vigencia de las vacunas ante la presión biológica ejercida frente al virus por parte de una población, en la que paulatinamente aumenta la proporción de individuos con anticuerpos, consecuencia de la vacunación y de las infecciones naturales.
Las nuevas variantes de SARS-CoV-2, pueden modificar la efectividad de las vacunas haciendo necesaria la revacunación con nuevas formulaciones adaptadas. Actualmente no se dispone de evidencia sólida sobre el impacto potencial
El segundo aspecto a tener en cuenta en el futuro, es la necesidad de contemplar a la población pediátrica como un reservorio de menor entidad, pero reservorio al fin, de una infección que, hasta ahora en ellos solo muy esporádicamente, da lugar a un cuadro grave como el síndrome inflamatorio multisistémico.
La epidemiología de COVID-19 en relación con las nuevas variantes de SARS-CoV-2, puede modificar la efectividad de las vacunas haciendo necesaria la revacunación con nuevas formulaciones adaptadas a las nuevas variantes. En el momento actual no se dispone de evidencia sólida sobre el impacto potencial de estas variantes en los entornos escolares, ni en general en la población pediátrica(17).
La protección contra la enfermedad por coronavirus 2019 (COVID-19) está mediada en gran parte por una respuesta inmune dirigida contra la proteína S de la espícula del SARS-CoV-2. La fracción S1 de esa glicoproteína es responsable de la unión entre el virus y la célula diana mediante una parte concreta de la misma, el RBD que interacciona con el receptor ACE2 de las células humanas y es la diana viral de los anticuerpos neutralizantes (AcN). Los AcN se unen a la proteína S en unos pocos sitios, normalmente en el RBD; al hacerlo, los AcN bloquean la unión del virus al receptor ACE2 de las células humanas.
Las variantes aparecidas contienen distintas mutaciones afectando alguna de ellas a la proteína S lo que puede aumentar la cantidad de virus excretado por las personas infectadas o incrementar la afinidad por el receptor ACE2, aumentando la transmisión del virus, aspecto clave en el contexto actual de la pandemia. Dichas mutaciones pueden, además, cambiar la forma de la proteína S y modificar los sitios de unión de los AcN y con ello, comprometer la eficacia de las vacunas. Estas “mutaciones de escape” normalmente surgen cuando el virus es sometido a una presión biológica selectiva mediada por anticuerpos que limitan, pero no eliminan totalmente la replicación viral. En estas condiciones, el virus puede encontrar una manera de escapar de dicha presión y restaurar su capacidad para reproducirse de manera más eficiente en presencia de determinadas concentraciones de anticuerpos.
Las variantes aparecidas contienen distintas mutaciones afectando alguna de ellas a la proteína S lo que puede aumentar la cantidad de virus excretado por las personas infectadas o incrementar la afinidad por el receptor ACE2, aumentando la transmisión del virus
Esa presión evolutiva frente al virus tiene lugar en todo el mundo. El primer cambio importante en las propiedades del SARS-CoV-2 tuvo lugar a principios de la pandemia, entre marzo y abril de 2020. Dicha variante, aumentó la eficiencia de replicación y la transmisibilidad del virus sin mayor gravedad y sin escapar al reconocimiento de los AcN y reemplazó a la cepa original en todo el mundo. Esa primera nueva variante llamada D614G supuso una advertencia de lo que podría suceder, al igual que las siguientes aparecidas desde agosto suponen la segunda advertencia(18).
En agosto de 2020, una nueva variante empezó a extenderse en el Reino Unido (uno de los países que más proporción de virus secuencia), observando que se extendía rápidamente por el país entre noviembre de 2020 y enero de 2021. Esta variante conocida como B.1.1.7, también denominada “variante UK” (United Kindom, Reino Unido), se ha detectado en muchos países, incluida España. Una de las mutaciones clave que alberga en la proteína S se llama N501Y, y parece también aumentar la transmisibilidad del SARS-CoV-2, aunque por un mecanismo distinto de la variante D614G. Sin embargo, parece que la ubicación de la mutación N501Y no afecta a la mayoría de los sitios de unión de AcN en el RBD(19). Hay datos que muestran como el suero de personas vacunadas con vacunas de ARNm de Pfizer/BioNTech y Moderna siguen siendo efectivas para neutralizar los virus con dicha mutación(20,21).
Recientemente ha aparecido otra variante más transmisible en el sur de California, CAL.20C, con una mutación en el RBD llamado L452Y que podría actuar de igual forma que N501Y. Entre todas las variantes recientemente aparecidas, dos preocupan especialmente. Una es la 1.351, aparecida en Sudáfrica con la mutación N501Y.V2 y otra la denominada P.1, aparecida en Brasil, en la región de Manaos en la Amazonía, en un entorno poblacional con alta prevalencia de personas que habían pasado ya la infección. Estas cepas tienen más de 18 mutaciones en distintas proteínas estructurales del virus además de la S, y ya hay estudios que afirman reducciones en los títulos de plasma y anticuerpos monoclonales específicos del 30% que bloquean al virus, y los anticuerpos generados por la vacuna de Moderna son hasta seis veces menos bloqueantes frente a la variante N501Y.V2 (sudafricana)(21).
Todavía no está suficientemente claro si estas variantes y la disminución de la eficacia de neutralización frente a ellas serán suficientes para anular totalmente el efecto protector de las vacunas
Todavía no está suficientemente claro si estas variantes y la disminución de la eficacia de neutralización frente a ellas, serán suficientes para anular totalmente el efecto protector de las vacunas. Una cosa son los ensayos in vitro con pseudovirus o coronavirus quimera o la pérdida de actividad neutralizante del
plasma de convalecientes o de anticuerpos monoclonales, y otra la efectividad de la respuesta inmune de la vacuna en el seguimiento real de los vacunados. Otros factores como la respuesta celular de células T-helper y T citotóxicas provocada por las vacunas RNAm y la inducción de títulos muy elevados de anticuerpos pueden contribuir a que, a pesar de las reducciones descritas de neutralización, las vacunas continúen siendo eficaces frente a las variantes aparecidas. Tampoco se conoce como puede ser el comportamiento frente a las nuevas variantes de otras vacunas, que pueden generar menores títulos de anticuerpos o contra distintas proteínas del virus (internas y externas).
Será necesario prestar mucha atención a las infecciones que se produzcan entre las personas vacunadas, secuenciando con rapidez los virus detectados y aislando con diligencia a dichas personas pues será entonces cuando las mutantes de escape puedan extenderse y difundir en la población reduciendo la eficacia de las vacunas
Será necesario prestar mucha atención a las infecciones que se produzcan entre las personas vacunadas, secuenciando con rapidez los virus detectados y aislando con diligencia a dichas personas pues será entonces cuando las mutantes de escape puedan extenderse y difundir en la población reduciendo la eficacia de las vacunas. Por otra parte, los diseños de vacunas ARNm y las vacunas de vectores de adenovirus de replicación defectiva pueden reformularse y adaptarse a las mutaciones de escape de las nuevas variantes. Mientras hay que tener presente que nuevas y viejas variantes siguen transmitiéndose de la misma forma, las nuevas variantes no se propagan mayoritariamente por aerosolización de forma similar al virus del sarampión ni recorren grandes distancias. El uso de máscaras, el distanciamiento físico y la aplicación del sentido común pueden prevenir su propagación.
El papel que puedan jugar los niños en la siguiente fase de la pandemia está lleno de interrogantes
El papel que puedan jugar los niños en la siguiente fase de la pandemia está lleno de interrogantes, los niños que padecen infecciones asintomáticas y de mucha menor gravedad y a los que no se vacunará en el corto plazo pueden jugar un papel secundario pero residual y de persistencia del virus contribuyendo por otra parte a la “normalización” del virus entre la población. No se conoce con precisión cual es la consecuencia inmune y patogénica para los niños que ya han sufrido una infección por el virus en reinfecciones posteriores, tampoco la presión biológica que el virus pueda experimentar cuando una gran parte de la población esté ya vacunada. Se desconoce si la evolución futura del virus tenderá de alguna manera a “colonizar” a la población infantil con más frecuencia de la que actúa y de forma preferentemente banal o asintomática.
A medida que las primeras vacunas contra el SARS-CoV-2 se implementan en los grupos de mayor riesgo, la etapa actual de la pandemia COVID-19 está abierta a distintos escenarios. En el medio plazo, la inmunidad de grupo eficaz requerirá la vacunación pediátrica. Es probable que la vacunación de los niños tenga beneficios tanto directos, protegiendo a los niños contra casos pediátricos graves raros de COVID-19 y patologías raras post infecciosas como el síndrome inflamatorio multisistémico, como indirectos; protegiendo a sus familias y entornos, al reducir la difusión. Esos beneficios “indirectos” pueden incluir también eliminar la ansiedad familiar de los padres y facilitar la apertura de los colegios en condiciones de verdadera normalidad. Todo ello debe ser puesto en valor por los pediatras.
El camino hacia la vacunación pediátrica requerirá una expansión gradual de los grandes ensayos de adultos a los de adolescentes y posteriormente en niños más pequeños. Pfizer ha obtenido la aprobación de la FDA (Food and Drug Administration) para probar la vacuna en niños de hasta 12 años en EE.UU., y ha finalizado la inscripción de 2.259 adolescentes de 12 a 15 años a finales de enero y espera continuar con un ensayo pediátrico de niños de 5 a 11 años para la primavera 2021. Por su parte AstraZeneca, ya ha iniciado ensayos de vacuna en niños de 5 a 12 años en el Reino Unido. De igual forma Moderna inició a finales de diciembre de 2020, la inscripción en el estudio Teen Cove para adolescentes de 12 a 17 años. Por su parte la Academia de Pediatría de EE.UU. ha instado a una acción más rápida en los ensayos de vacunas pediátricas ya que los niños pueden quedarse atrás cuando los adultos estén mayoritariamente protegidos(22).
Según Anthony Faucy, durante los próximos meses de 2021, se realizarán ensayos con una reducción de la edad, y los estudios se trasladarán gradualmente a los niños más pequeños, estimando que a medida que se llegue a finales de la primavera y el verano, habrá ya niños que podrían ser vacunados(23). Todas estas recientes declaraciones deben alertar a los pediatras sobre el futuro próximo en el que se dispondrá de publicaciones que tendrán que valorarse por las distintas sociedades científicas.
Se precisan datos de ensayos pediátricos de seguridad y los pediatras deben prepararse para campañas de desinformación que se aprovechen de los temores de los padres, suscitados por los movimientos antivacunas cada vez que aparece una nueva vacuna
Por ello, proteger a los niños contra la infección por SARS-CoV-2 es tanto una obligación ética como una necesidad práctica que debe tener una firme base científica. Se precisan datos de ensayos pediátricos de seguridad y los pediatras deben prepararse para campañas de desinformación que se aprovechen de los temores de los padres, suscitados por los movimientos antivacunas cada vez que aparece una nueva vacuna(24).
El mundo de las infecciones de transmisión respiratoria, y especialmente las de etiología vírica, es complejo y se ha labrado tras siglos de convivencia e interacción virus/huésped con variados aspectos patogénicos y epidemiológicos. Hasta ahora no se ha conseguido erradicar ninguna de esas infecciones, quizás esta pueda ser una excepción, pero ello pasa en todo caso por la inmunidad de los más pequeños, sin ella el control de SARS-CoV-2 y la COVID-19 se antoja difícil.
Tablas y figuras
Tabla I. Tipos, número y porcentaje de vacunas frente a la COVID-19 en fase clínica en el mes de febrero de 2021
|
Tecnología vacunal |
Nº vacunas candidatas |
% vacunas candidatas |
|
Subunidades proteicas |
24 |
33% |
|
Vector viral (no replicativo) – (VVnr) |
11 |
15% |
|
DNA |
11 |
15% |
|
Virus inactivado |
10 |
14% |
|
RNA |
8 |
11% |
|
Vector viral (replicativo) – (VVr) |
3 |
4% |
|
VLPs |
2 |
23% |
|
VVr + Célula Presentadora de Antígenos |
2 |
3% |
|
Virus vivo atenuado |
1 |
1% |
|
VVnr + Célula Presentadora de Antígenos |
1 |
1% |
Elaboración propia
Tabla II. Principales vacunas frente al SARS-CoV-2 según el tipo de tecnología usada, pauta de vacunación y edad
|
Tipo Tecnología |
Vacuna |
Desarrolladores |
Nº Dosis |
Intervalo |
Edad |
|
RNA |
|
|
|
|
|
|
|
BNT162b1 |
Pfizer/BioNTech |
2 |
Días 0 + 21 |
≥18 años |
|
|
mRNA-1273 |
Moderna |
2 |
Días 0 + 28 |
≥18 años |
|
|
CVnCOV |
CureVac AG |
2 |
Días 0 + 28 |
≥18 años |
|
Vectores |
|
|
|
|
|
|
|
ChAdOx1 nCoV-19 (AZD1222) |
Astra-Zeneca |
1-2 |
Días 0 + 28 |
18-65 años |
|
|
Adeno-based (rAd26-S + rAd5-S) |
Gamaleya Research Institute |
2 |
Días 0 + 21 |
≥18 años |
|
|
Ad26COVS1 |
Janssen Pharmaceuticals |
1-2 |
Días 0 + 56 |
≥18 años |
|
|
Adenovirus Type 5 Vector |
Cansino Biological Inc. |
1 |
Día 0 |
≥18 años |
|
Virus inactivados |
|
|
|
|
|
|
|
SARS-CoV-2 Vaccine |
SinoVac BioTech |
2 |
Días 0 + 14 |
18-60 años |
|
|
Inactivated SARS-CoV-2 vaccine |
SinoPharm |
2 |
Días 0 + 21 |
18-60 años |
|
Subunidades protéicas |
|
|
|
|
|
|
|
SARS-CoV-2 rS/Matrix M1-Adjuvant |
Novavax |
2 |
Días 0 + 21 |
≥18 años |
Basada en referencia (16)
Figura 1. Esquema de la estructura vírica del SARS-CoV-2

Figura 2. Clasificación epidemiológica e histórica de las especies de coronavirus humanos
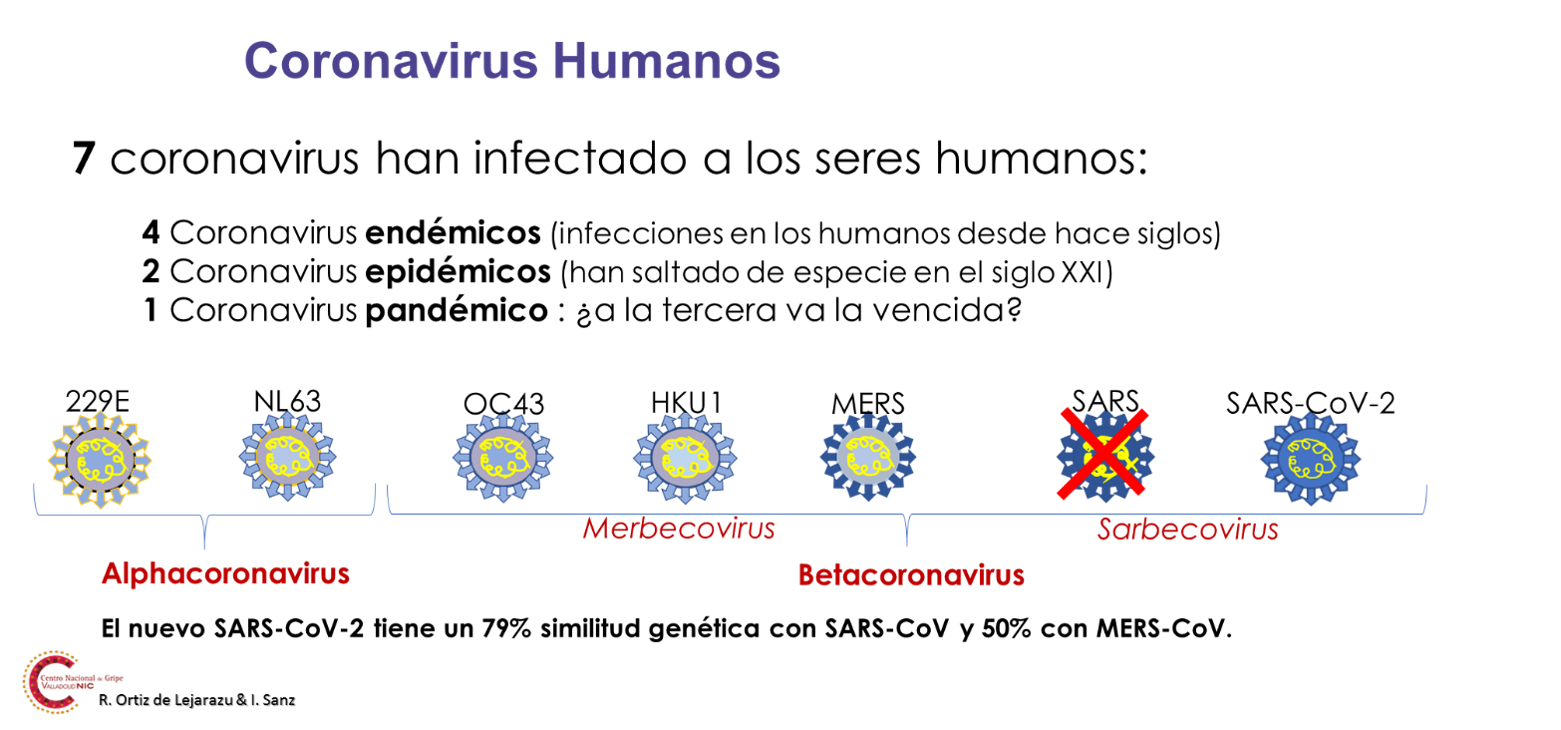
Figura 3. Tipos de vacunas que se están diseñando y utilizando frente al SARS-CoV-2
Bibliografía
1. Johansen TB, Astrup E, Jore S, Nilssen H, Dahlberg BB, Klingenberg C, et al. Infection prevention guidelines and considerations for paediatric risk groups when reopening primary schools during COVID-19 pandemic, Norway, April 2020. Eurosurveillance. 2020;25.
2. ECDC. COVID-19 in children and the role of school settings in transmission – first update [Internet]. 2020 [Citado 24 de febrero de 2020]. Disponible en: https://www.ecdc.europa.eu/en/publications-data/children-and-school-settings-covid-19-transmission.
3. Opel DJ, Diekema DS, Ross LF. Should We Mandate a COVID-19 Vaccine for Children? JAMA Pediatr. 2021;175:125-6.
4. OMS. The COVID-19 candidate vaccine landscape [Internet]. 2021 [Citado 19 de febrero de 2021]. Disponible en: https://www.who.int/publications/m/item/draft-landscape-of-covid-19-candidate-vaccines.
5. Erasmus JH, Khandhar AP, O’Connor MA, Walls AC, Hemann EA, Murapa P, et al. An Alphavirus-derived replicon RNA vaccine induces SARS-CoV-2 neutralizing antibody and T cell responses in mice and nonhuman primates. Sci Transl Med. 2020;12(555).
6. Berglund P, Smerdou C, Fleeton MN, Tubulekas I, Liljeström P. Enhancing immune responses using suicidal DNA vaccines. Nat Biotechnol. 1998;16:562-5.
7. Polack FP, Thomas SJ, Kitchin N, Absalon J, Gurtman A, Lockhart S, et al. Safety and Efficacy of the BNT162b2 mRNA Covid-19 Vaccine. N Engl J Med. 2020;383:2603-15.
8. Baden LR, El Sahly HM, Essink B, Kotloff K, Frey S, Novak R, et al. Efficacy and Safety of the mRNA-1273 SARS-CoV-2 Vaccine. N Engl J Med. 2021;384:403-16.
9. Israel Seeing Mortality Decline in Vaccinated Age Group [Internet]. Medscape. [Citado 18 de febrero de 2021]. Disponible en: http://www.medscape.com/viewarticle/945700.
10. La vacuna de Oxford/AstraZeneca contra la COVID-19: lo que debe saber [Internet]. [Citado 18 de febrero de 2021]. Disponible en: https://www.who.int/es/news-room/feature-stories/detail/the-oxford-astrazeneca-covid-19-vaccine-what-you-need-to-know.
11. Logunov DY, Dolzhikova IV, Shcheblyakov DV, Tukhvatulin AI, Zubkova OV, Dzharullaeva AS, et al. Safety and efficacy of an rAd26 and rAd5 vector-based heterologous prime-boost COVID-19 vaccine: an interim analysis of a randomised controlled phase 3 trial in Russia. Lancet. 2021;397:671-81.
12. Sadoff J, Le Gars M, Shukarev G, Heerwegh D, Truyers C, de Groot AM, et al. Interim Results of a Phase 1–2a Trial of Ad26.COV2.S Covid-19 Vaccine. N Engl J Med. 2021;NEJMoa2034201(0):null.
13. Zhu F-C, Guan X-H, Li Y-H, Huang J-Y, Jiang T, Hou L-H, et al. Immunogenicity and safety of a recombinant adenovirus type-5-vectored COVID-19 vaccine in healthy adults aged 18 years or older: a randomised, double-blind, placebo-controlled, phase 2 trial. Lancet. 2020;396:479-88.
14. Iversen PL, Bavari S. Inactivated COVID-19 vaccines to make a global impact. Lancet. 2021;S1473-3099(21)00020-7.
15. Novavax. Novavax COVID-19 Vaccine Demonstrates 89.3% Efficacy in UK Phase 3 Trial [Internet]. 2021 [Citado 19 de febrero de 2021]. Disponible en: https://ir.novavax.com/node/15506/pdf.
16. Dong Y, Dai T, Wei Y, Zhang L, Zheng M, Zhou F. A systematic review of SARS-CoV-2 vaccine candidates. Signal Transduct Target Ther. 2020;5:1-14.
17. Moore JP, Offit PA. SARS-CoV-2 Vaccines and the Growing Threat of Viral Variants. JAMA. 2021.
18. Korber B, Fischer WM, Gnanakaran S, Yoon H, Theiler J, Abfalterer W, et al. Tracking Changes in SARS-CoV-2 Spike: Evidence that D614G Increases Infectivity of the COVID-19 Virus. Cell. 20 de agosto de 2020;182(4):812-827.e19.
19. Starr TN, Greaney AJ, Hilton SK, Crawford KHD, Navarro MJ, Bowen JE, et al. Deep mutational scanning of SARS-CoV-2 receptor binding domain reveals constraints on folding and ACE2 binding. bioRxiv. 2020.
20. Xie X, Zou J, Fontes-Garfias CR, Xia H, Swanson KA, Cutler M, et al. Neutralization of N501Y mutant SARS-CoV-2 by BNT162b2 vaccine-elicited sera. bioRxiv. 2021;2021.01.07.425740.
21. Wu K, Werner AP, Moliva JI, Koch M, Choi A, Stewart-Jones GBE, et al. mRNA-1273 vaccine induces neutralizing antibodies against spike mutants from global SARS-CoV-2 variants. bioRxiv. 2021.
22. Michele Cohen Marill. Start Pediatric Vaccine Trials for COVID-19 Now, Experts Urge [Internet]. Medscape. 2020 [Citado 24 de febrero de 2021]. Disponible en: http://www.medscape.com/viewarticle/939521.
23. Michele Cohen Marill. Teenagers Get in the Queue for COVID Vaccines [Internet]. Medscape. 2021 [Citado 24 de febrero de 2021]. Disponible en: http://www.medscape.com/viewarticle/945331.
24. Klass P, Ratner AJ. Vaccinating Children against Covid-19 – The Lessons of Measles. N Engl J Med. 2021;384:589-91.




