Adolescente con TEA y problemas relacionados con el sueño
Adolescente con TEA y problemas relacionados con el sueño
G. Pin Arboledas. Unidad de Pediatría Integral. Unidad de Sueño Hospital Quironsalud, Valencia.
Adolescere 2021; IX (2): 128-137
Resumen
|
El sueño del adolescente se caracteriza por un retraso biológico en el inicio y finalización de la secreción nocturna de melatonina. Además de esos cambios madurativos fisiológicos, se añaden la irregularidad de horarios los fines de semana, el déficit de sueño en los días escolares, el uso de los dispositivos tecnológicos sobre todo antes de ir a la cama que produce la supresión de la secreción de melatonina; todo ello dificulta que el adolescente cubra sus necesidades biológicas de sueño. Los problemas del sueño en la adolescencia, pueden condicionar la salud en etapas posteriores de la vida, por ello mejorar el sueño del adolescente es mejorar el sueño y la calidad de vida en las etapas posteriores de la vida. Los problemas con el sueño tienen una prevalencia de hasta el 86% en sujetos con trastornos del neurodesarrollo siendo los más frecuentes el insomnio de inicio, los despertares nocturnos y la disminución del tiempo total de sueño. Se plantea el caso clínico de un varón adolescente con insomnio de inicio y episodios esporádicos de excesiva somnolencia diurna. Palabras clave: Adolescente; Sueño; Insomnio; Autismo. |
Abstract
|
Adolescent sleep is characterized by a biological delay in the initiation and termination of nocturnal melatonin secretion. In addition to these physiological maturation changes, the irregularity of schedules on weekends, the sleep deficit on school days, the use of technological devices, especially before going to bed, which produces the suppression of melatonin secretion, are added. All of this makes it difficult for the adolescent to meet their biological needs for sleep. Sleep problems in adolescence can condition health in later stages of life, therefore improving adolescent sleep is to improve sleep and quality of life in later stages of life. Sleep problems have a prevalence of up to 86% in subjects with neurodevelopmental disorders, the most frequent being onset insomnia, nocturnal awakenings and a decrease in total sleep time. The clinical case of a male adolescent with onset insomnia and sporadic episodes of excessive daytime sleepiness is presented. Key words: Adolescent; Sleep; Insomnia; Autism. |
Introducción
El sueño del adolescente se caracteriza por un retraso biológico en el inicio y finalización de la secreción nocturna de melatonina
El sueño del adolescente se caracteriza por un retraso biológico en el inicio y finalización de la secreción nocturna de melatonina de manera que el punto medio de sueño se retrasa 2 horas en las niñas y 3 horas en los niños a lo largo de la segunda década de la vida o lo que es lo mismo, alrededor de 12 y 18 minutos respectivamente cada año. La finalización de este retraso progresivo es un marcador biológico del final de la adolescencia.
La combinación de estos cambios madurativos dificulta que el adolescente inicie el sueño en los días escolares a una hora semejante al preadolescente; de esta manera, disminuye la posibilidad de un despertar refrescante que le prepare para atender las clases a primera hora de la mañana.
La irregularidad de los horarios los fines de semana, esto es, acostarse más tarde y alargar el sueño por las mañanas los fines de semana es un claro reflejo del ritmo circadiano vespertino típico de la adolescencia y, al mismo tiempo, una respuesta al déficit de sueño de los días escolares. Estos cambios en la ritmicidad del sueño los fines de semana favorecen el retraso del inicio de la secreción nocturna de melatonina y eliminan la presión de sueño residual. Estos hábitos, junto con el uso a última hora del día de la tecnología y la consabida supresión de la secreción de melatonina por la luz de los dispositivos, son un factor más, que dificulta que el adolescente cubra sus necesidades biológicas de sueño.
Algunos hábitos de la adolescencia, dificultan que el adolescente cubra sus necesidades biológicas de sueño
Junto a la regulación circadiana del sueño el otro componente de la regulación del sueño es el proceso homeostático, es decir, la presión de sueño en función del tiempo de vigilia previo: si el sueño está restringido, la presión de sueño aumenta. Los datos de los que hoy disponemos indican que en los adolescentes, al contrario de lo que ocurre en edades posteriores, la homeostasis del sueño se conserva bajo restricción crónica de sueño. Esto viene a indicar que en la adolescencia no se produce una adaptación a la restricción de sueño.
En la adolescencia no se produce una adaptación a la restricción de sueño
Los horarios escolares tienen una gran influencia en el sueño del adolescente. Cada 10 minutos de retraso en el horario de inicio del horario escolar se corresponde a un incremento de la probabilidad de obtener suficiente tiempo de sueño (2.1%;95% CI: 1.0, 3.2), más minutos de sueño (3.2;95% (CI: 2.0, 4.5) así como a una disminución de la sensación de cansancio durante el horario escolar.
En el estudio SHASTU (Sleep Habits in Student´s Performance, financiado por la UE dentro del programa Erasmus plus) el porcentaje de adolescentes españoles que superan la línea de corte de una mala calidad de sueño pasa del 22,5% al 12,3% tras establecer durante dos años unos correctos hábitos e higiene del sueño dentro del programa formativo de los centros educativos. La misma situación se produce en la subescala que valora la Somnolencia Diurna Excesiva (SDE).
La presencia de problemas del sueño en la adolescencia puede condicionar la salud en etapas posteriores: 1/3 de los adolescentes que presentan problemas del sueño a los 16 años los tienen aún a los 23 años y un 10% a los 42 años. Así pues, mejorar el sueño del adolescente es mejorar el sueño y la calidad de vida no solo en la adolescencia sino en etapas posteriores de la vida.
Se detecta una relación dosis – respuesta entre la duración del tiempo de sueño (TTS) y el uso de tecnología con una OR de un TTS menor de 5 h de 2.70 (95% CI: 2.14-3.39).
Los problemas con el sueño tienen una prevalencia de hasta el 86% en sujetos con trastornos del neurodesarrollo, siendo los más frecuentes el insomnio de inicio, los despertares nocturnos y la disminución del tiempo total de sueño (TTS)
Los problemas con el sueño tienen una prevalencia de hasta el 86% en sujetos con trastornos del neurodesarrollo, siendo los más frecuentes el insomnio de inicio, los despertares nocturnos y la disminución del tiempo total de sueño (TTS). El sueño proporciona una ventana de tiempo para la reactivación y reorganización de los circuitos neuronales que se activaron durante la experiencia emocional inicial. Por ejemplo, mientras que la amígdala se activa inicialmente durante una experiencia emocionalmente angustiante, la reorganización posterior de la red neuronal que se facilita con el sueño resulta en la inhibición de la amígdala si la experiencia se recuerda o se encuentra de nuevo más tarde. Este hecho cobra mayor relevancia en presencia de TEA.
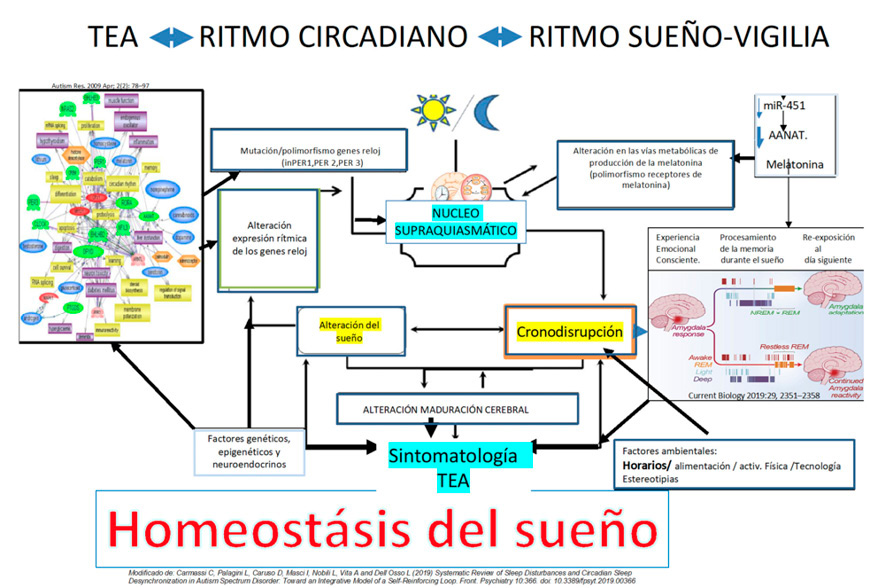
Las causas de los problemas del sueño en los portadores de un TEA son multifactoriales (Figura 1) y entre ellas destaca una baja concentración de melatonina plasmática por déficit primario de la actividad de la acetilserotonina metiltransferasa. Los genes reloj circadianos pueden expresarse de forma diferente en el TEA.
Aunque el déficit de sueño es un factor de riesgo para la salud que es reversible, no lo son algunas de sus consecuencias si este déficit perdura en el tiempo:
- El sueño insuficiente en el adolescente se ha relacionado con mayor tendencia a depresión e ideaciones suicidas: los trastornos del sueño en los adolescentes predicen el riesgo de ideación suicida pero no los intentos de suicidio (OR:1,79 y 1,98; IC: 1,36-2,36 y 0,62-6,29 respectivamente).
- Obesidad: existe suficiente evidencia científica que relaciona el sueño insuficiente en niños y adultos con un aumento del riesgo de obesidad.
- Bajo rendimiento escolar.
- Depresión: se ha evidenciado una relación entre incremento de sintomatología depresiva con una disminución de la actividad física y mayores problemas con el sueño.
- El riesgo de desarrollar una diabetes tipo 2 por déficit crónico de sueño es semejante al riesgo que conllevan los factores tradicionales como el exceso de peso, la vida sedentaria o la historia familiar; situación que hace que el sueño deba ser componente importante de las guías clínica de esta alteración metabólica.
Caso clínico
Pedro. Edad de consulta: 14 años.
Motivo de consulta: le cuesta conciliar el sueño. Despertares nocturnos. Tiene sueño por el día.
Antecedentes familiares: madre: 50 años. VS. No problemas relacionados con el sueño. Cronotipo matutino. Padre: 52 años. Portador de CPAP por SAHS. Cronotipo vespertino intenso. Hermana de 12 años VS. Sospecha de cronotipo vespertino.
Antecedentes personales: perinatal sin alteraciones. Diagnosticado a los 4 años de TEA con altas capacidades. Alergia a dermatophagoides y crisis de broncoespasmo de repetición. Actualmente portador de tratamiento profiláctico con antileucotrienos y corticoides de liberación prolongada. Los padres han rechazado medicación relacionada con el TEA.
Remitidos a la consulta de sueño por su psiquiatra por presentar dificultades de inicio de sueño y episodios esporádicos de excesiva somnolencia diurna a pesar de diferentes tratamientos conductuales y farmacológicos. Aporta una polisomnografía realizada en otro centro 6 meses antes en la que se descarta la presencia de grafoelementos patológicos durante el sueño, presencia de trastorno respiratorio del sueño o síndrome de movimiento periódico de las piernas. Tiempo de vigilia intrasueño (WASO) > 110 minutos. Los padres refieren tratamiento psicopedagógico habitual.
Ya en la consulta de sueño
Exploración clínica dentro de los parámetros de la normalidad a excepción de TEA ya conocido. No refiere “ataques de sueño”, protrusión lingual ni clínica de cataplejias. La somnolencia diurna está claramente relacionada con el tiempo total de sueño (TTS) y las interrupciones nocturnas.
Somatometría: se encuentra en el percentil 75 de peso y talla.
Pruebas complementarias solicitadas en Unidad de Sueño
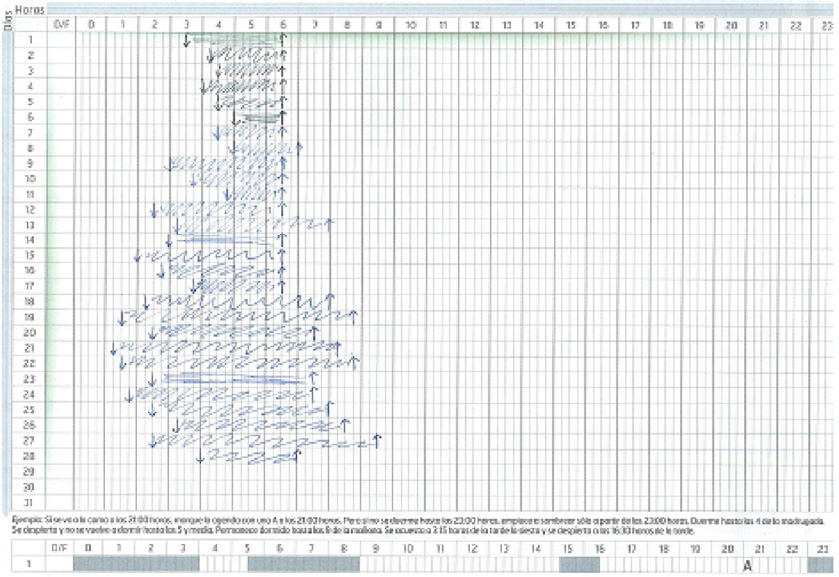
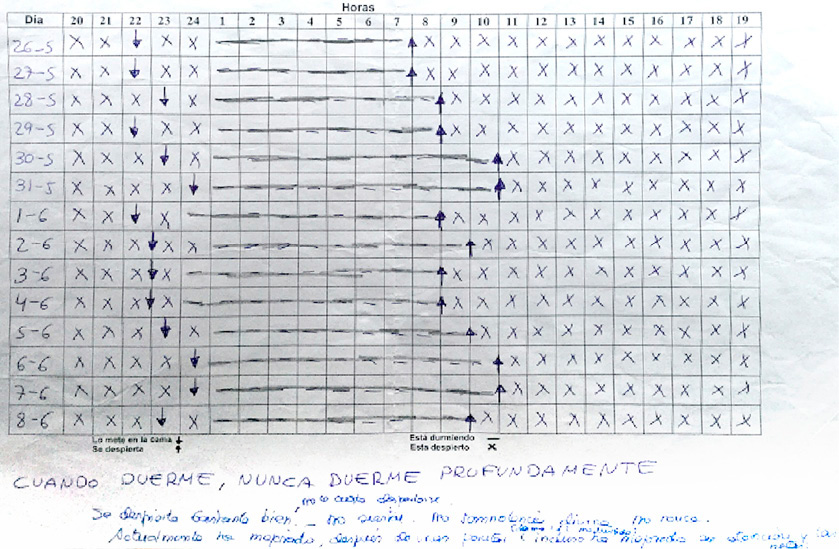
- Agenda de sueño libre (Figuras 2 y 3).
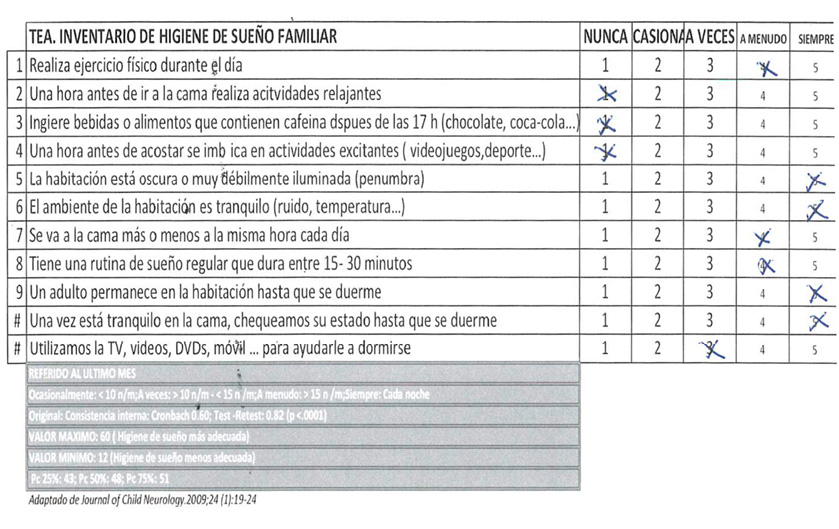
- Higiene de sueño en niños con TEA (Figura 4).
- Cuestionario de componente físico de los problemas de sueño en niños con TEA (Figura 5).
- Cuestionario de sueño adaptado a niños con TEA (Tabla I).
- Cuestionario VESPERTINO-MATUTINO.
Análisis de las pruebas complementarias
- Agenda libre de sueño inicial:
- Déficit crónico de tiempo de sueño por debajo del percentil 3 la mayoría de los días.
- Inicio de sueño tardío compatible con la presencia de un S. de Retraso de Fase circadiana.
- Higiene de sueño en niños con TEA:
- La puntuación obtenida es de 38; indica una aceptable higiene de sueño.
- Como conducta diana a mejorar destaca la necesidad de implantar acciones relajantes 1 hora antes de la rutina de sueño. Estas acciones relajantes son diferentes para cada uno de los adolescentes y cada una de las familias por lo que deben establecerse de manera personalizada tras valoración conjunta.
- Cuestionario de componente físico:
- Destaca la presencia de S. de Piernas Inquietas que puede ser un contribuyente en el incremento de la latencia de sueño (y la probable justificación de la administración de hierro).
- Presencia de dermatitis atópica. Esta situación siempre la debemos descartar como contribuyente a disminución de la calidad y eficiencia del sueño, así como ante la presencia de despertares nocturnos.
El componente físico en ocasiones pasa desapercibido y dificulta la eficacia terapéutica.
- Cuestionario de sueño adaptado a niños con TEA:
- Presencia de sueño inquieto (muy frecuente en TEA).
- Somnolencia diurna. No existe cuestionario de Excesiva Somnolencia Diurna adaptado a niños con TEA por lo que debemos basarnos en la opinión subjetiva de pacientes y/o familiares.
- Se observa cierto nivel de ansiedad. Un 56-70% de los niños con TEA tienen un mayor grado de ansiedad y SOR (sensory over-responsivity) que predispone a problemas con el sueño.
- Cuestionario VESPERTINO-MATUTINO.
Es necesario al valorarlo tener en cuenta que NO está validado específicamente en pacientes portadores de TEA. En este caso se utilizó como orientativo y por los antecedentes paternos de marcada tendencia vespertina.
Sospecha diagnóstica relacionada con el sueño
- Insomnio crónico. ICD-9-CM Código: 307.42.
- S. Retraso de Fase circadiana. ICD-9-CM Código: 327.31.
- S. Piernas Inquietas. ICD-9-CM Código: 333.94.
Propuesta terapéutica
Cada ser humano tiene su propio ritmo vigilia-sueño
Cada ser humano tiene su propio ritmo vigilia-sueño. Los matutinos o “alondras” están más activos y receptivos en las primeras horas del día, son más sensibles a los efectos de la luz por las mañanas y tienen tendencia a dormirse pronto en la noche mientras los vespertinos o “búhos” tienen tendencia a dormirse tarde, están más activos a última hora del día, presentan mayor sensibilidad vespertina a la luz y prefieren despertarse tarde siendo menos sensibles a los efectos de la luz por las mañanas. Estas preferencias están controladas por el reloj biológico hipotalámico compuesto por miles de neuronas, cada una con su oscilador circadiano, que generan y mantienen un ritmo endógeno que debe ser sincronizado con el horario solar de una manera regular día a día, preferentemente por la luz y actividades sociales regulares (horario de comidas, horario de sueño, etc.): la introducción de ritmos y rutinas regulares es básica para su funcionamiento apropiado.
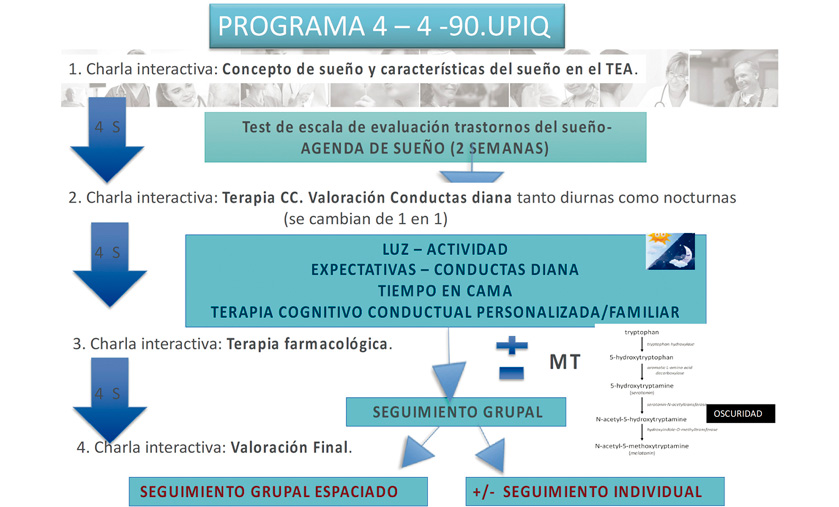
Se propuso la aplicación del programa 4-4-90. El programa consta de 4 sesiones cada 4 semanas con una duración cada una de ellas de 90 minutos (“Programa 4-4-90”).
El paso previo es la identificación clara de los objetivos terapéuticos, evaluación de posibles elementos colaboradores al mantenimiento del problema y el diseño de expectativas realistas siendo modestos y creando un ambiente rutinario, tranquilo, oscuro, con temperatura adecuada, no estimulante y con escasos o nulos estímulos auditivos o visuales (tecnología).
En la Figura 6 se representa el esquema del plan de tratamiento; cada una de las 4 sesiones está estructurada:
- Exposición teórica sobre el sueño por parte de un profesional de la Unidad: Concepto de sueño y su regulación, bases de la terapia psicológica, conceptos sobre farmacología y sueño y evaluación final.
- Valoración de las agendas y cuestionarios de cada paciente por parte de todo el grupo.
- Elaboración de recomendaciones terapéuticas individualizadas.
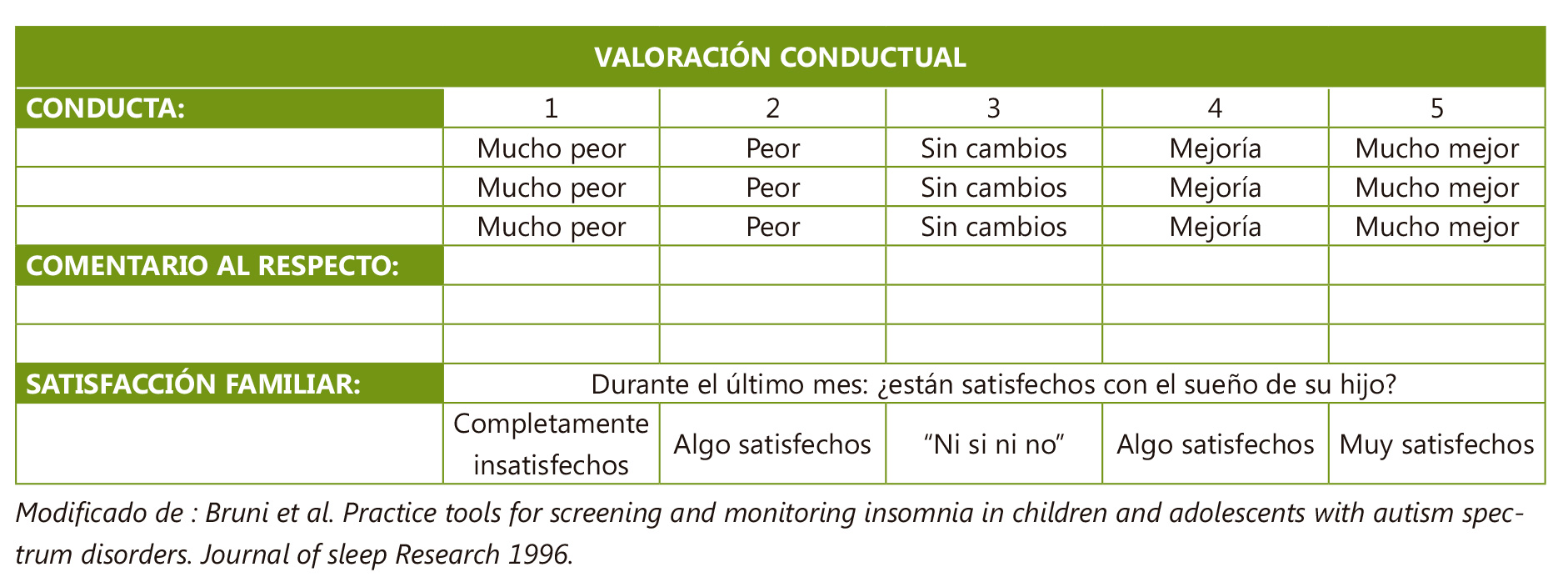
Un aspecto importante del tratamiento de los trastornos del sueño en adolescentes con TEA es el abordaje del trastorno del ritmo circadiano (generalmente retraso de fase) que condiciona, en gran medida, el resto de la clínica y la respuesta terapéutica y los cambios conductuales haciendo uso de la tabla de la Figura 7.
En cuanto al tratamiento farmacológico de los trastornos del sueño es necesario tener en cuenta ciertas consideraciones generales, así como las posibles interacciones con otros fármacos (antiepilépticos):
- Valorar la medicación tomada previamente y las prescripciones homeopáticas o la fitoterapia.
- Establecer previamente junto con los padres y/o el propio niño los objetivos del tratamiento. El objetivo inmediato es mejorar y no eliminar radicalmente el problema del sueño.
- Evitar la interrupción aguda de cualquier medicación relacionada con el sueño y monitorizar el tratamiento farmacológico teniendo en cuenta la tendencia natural de los padres a dar menos dosis de las recomendadas.
- Elección del fármaco guiada por una evaluación detallada del problema (dificultad de inicio, despertares nocturnos, etc.) y una detallada historia familiar.
Los tres grandes retos del tratamiento farmacológico son evitar la sedación residual, la tolerancia potencial y el mantenimiento de la mejora del sueño
Los tres grandes retos del tratamiento farmacológico son evitar la sedación residual, la tolerancia potencial y el mantenimiento de la mejora del sueño.
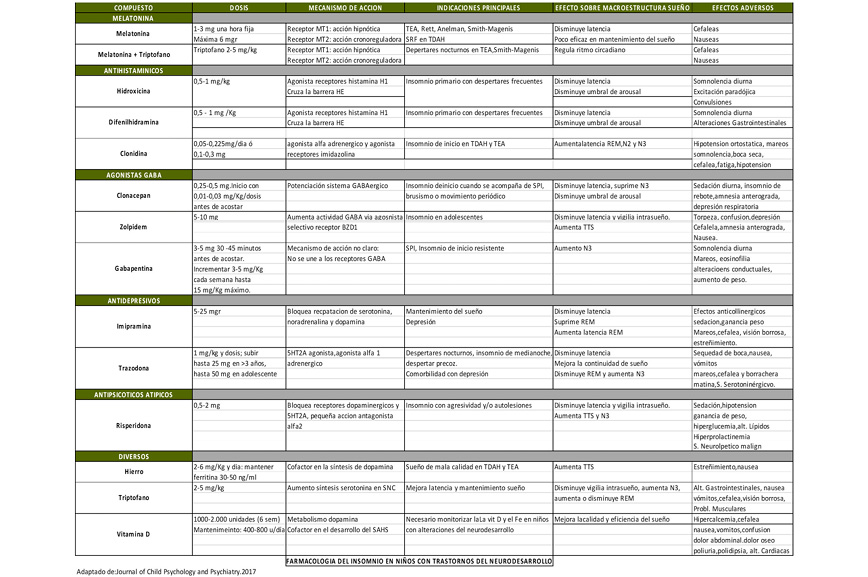
En la Tabla II se resumen las dosis y principales acciones de los fármacos más utilizados para el tratamiento de los trastornos del sueño en adolescentes con TEA. Próximamente dispondremos en el mercado español de una melatonina de liberación prolongada, catalogada como fármaco, con especial indicación en pacientes con TEA y trastornos del sueño. La experiencia actual muestra una aceptable respuesta, así como ausencia de repercusión en el desarrollo hormonal tras dos años de uso continuado (Journal of the American Academy of Child and Adolescent Psychiatry. 20212; 60:2)
En este caso se utilizó esta melatonina de liberación prolongada administrada 1 hora antes del inicio de sueño con disminución progresiva del WASO y adelanto de la fase circadiana.
Tablas y figuras
Tabla I.
Tabla II. Principales fármacos utilizados en los trastornos del sueño en TEA
Figura 1: Diagrama de la posible etiología de los trastornos del sueño en el TEA
Figura 2. Agenda de sueño inicial
Figura 3. Agenda de sueño a las 4 semanas
Figura 4. Higiene de sueño
Figura 5. Componentes físicos que pueden contribuir
Figura 6. Plan de tratamiento según el programa 4-4-90
Figura 7. Valoración evolutiva de los cambios conductuales
Modificado de : Bruni et al. Practice tools for screening and monitoring insomnia in children and adolescents with autism spectrum disorders. Journal of sleep Research 1996.
Bibliografía
- Sleep Health. Healthy People 2020 topics and objectives. Disponible en: www.healthypeople. gov/2020/topicsobjectives2020/overview.aspx? topicid=38.so Acceso el 10 de marzo 2019.
- Dregan A, Armstrong D. Adolescence sleep disturbances as predictors of adulthood sleep disturbances—a cohort study. J Adolesc Health 2010;46:482–7.
- American Academy of Pediatrics. Insufficient Sleep in Adolescents and Young Adults: An update on causes and consequences. Pediatrics.2014;134 (3).e921-e932.
- Kim M. Tsai, Ronald E. Dahl, Michael R. Irwin, Julienne E. Bower, Heather McCreath, Teresa E. Seeman, David M. Almeida,Andrew J. Fulign.The Roles of Parental Support and Family Stress in Adolescent Sleep. Child Dev. 2018 September ; 89(5): 1577–1588. doi:10.1111/cdev.12917.
- Gariepy G, Janssen I, Elgar FJ. School start time and sleep in Canadian adolescents. J Sleep Res.2017 Apr;26(2):195-201. doi: 10.1111/jsr.12475.
- Hysing M, et al. Sleep and use of electronic devices in adolescence: results from a large population-based study BMJ Open 2015;5:e006748.
- Jen-Wei Liu,Yu-Kang Tu, Ying-Fan Lai et asl. Associations between sleep disturbances and suicidal ideation,plans,and attemps in Adolescents: A systematic review and metanalysis. Sleep. 2019. doi.org/10.1093/sleep/zsz054.
- Pin G. El sueño en los niños con trastornos del neurodesarrollo. Medicina (Buenos Aires) 2019; Vol. 79 (Supl. I): 44-50.