Aspectos inmunológicos de la infección por meningococo
Aspectos inmunológicos de la infección por meningococo
F. Fariñas Guerrero.
Instituto de Inmunología Clínica y Enfermedades Infecciosas.
Fecha de recepción: 11 de febrero 2020
Fecha de publicación: 28 de febrero 2020
Adolescere 2020; VIII (1): 65-71
Resumen
|
La enfermedad meningocócica invasiva (EMI), se caracteriza por un componente inflamatorio/inmunopatológico sistémico, responsable en muchos casos de la muerte del paciente. En este artículo se exponen los aspectos generales de la respuesta inmune frente al meningococo y su variación según la edad ya que durante los primeros cinco años de vida ciertos mecanismos inmunitarios se encuentran en una fase importante de inmadurez. También los mecanismos de evasión empleados por el meningococo; la predisposición genética del huésped; los factores de riesgo inmunológico como las inmunodeficiencias, la hipo o asplenia y la quimioterapia; y los tipos de vacunas disponibles en la actualidad tanto frente al meningococo B, como frente a meningococo A, C, W, Y. Palabras clave: Inmunología; Meningococo; Vacunas. |
Abstract
|
Invasive meningococcal disease (IMD) is characterized by a systemic inflammatory / immunopathological component, responsible in many cases for the death of the patient. This article presents the general aspects of the immune response against meningococcus and its variation according to age, since during the first five years of life certain immune mechanisms are in an important phase of immaturity. Also the evasion mechanisms used by meningococcus; the genetic predisposition of the host; immune risk factors such as immunodeficiencies, hypo or aspenia, chemotherapy; and the types of vaccines currently available both against meningococcus B, and against meningococcus A, C, W, Y are here presented. Key words:Immunology; Meningococcus; Vaccines. |
Generalidades sobre la respuesta inmune frente a meningococo
La enfermedad meningocócica invasiva (EMI), que se origina desde estos lugares de colonización, se caracteriza por un componente inflamatorio/inmunopatológico sistémico, responsable en muchos casos de la muerte del paciente
A pesar de su virulencia potencial, Neisseria meningitidis es habitualmente un colonizador común de la nasofaringe y también de otros lugares anatómicos como la boca, el tracto urogenital e incluso el área ano-rectal(1). La enfermedad meningocócica invasiva (EMI), que se origina desde estos lugares de colonización, se caracteriza por un componente inflamatorio/inmunopatológico sistémico, responsable en muchos casos de la muerte del paciente.
Estudios pioneros realizados a finales de los años ochenta del pasado siglo XX, demostraron que la evolución desde el estado de colonización a la EMI, se puede facilitar por la producción de factores inflamatorios locales como la interleucina 1 (IL-1) y el factor de necrosis tumoral alfa (TNF-α)(2). Factores ambientales como el tabaco y algunos virus respiratorios como el de la gripe, pueden inducir estos factores inflamatorios locales(3). No cabe duda de que una respuesta inmunitaria equilibrada frente a esta infección podría controlar tanto el trágico final de muchas EMI, como eliminar el estado de colonización por parte de estos microorganismos.
La forma en que nos defendemos frente a la infección meningocócica se basa en la acción de los neutrófilos y macrófagos, la activación de la vía clásica y alternativa del complemento y la producción de anticuerpos
La forma en que nos defendemos frente a la infección meningocócica, se basa en la puesta en escena de tres mecanismos fundamentales que van desde la acción ejercida por neutrófilos y macrófagos, fagocitando y destruyendo estas bacterias, a la activación de las vías clásica y alternativa del complemento, y por supuesto la producción de anticuerpos. En referencia a estos últimos, se ha demostrado que los anticuerpos anti-polisacáridos ejercen una función protectora frente a la infección. Dentro de estos anticuerpos existen tanto aquellos que incrementan la actividad bactericida sérica (SBA), como otros que incrementan la capacidad de fagocitosis y destrucción de los meningococos (anticuerpos opsonofagocíticos)(4). Los anticuerpos que tienen actividad SBA ligan proteínas del complemento induciendo la lisis bacteriana (vía clásica del complemento). Además, el complemento puede activarse directamente sin intervención de anticuerpos, induciendo igualmente la lisis del meningococo (vía clásica del complemento).
Algunos anticuerpos que se generan frente a especies apatógenas como son Neisseria lactamica o Bacillus pumilus, pueden reconocer de forma cruzada antígenos de Neisseria meningitidis, contri-buyendo a generar una inmunidad adicional
Algunos anticuerpos que se generan frente a especies apatógenas como son Neisseria lactamica o Bacillus pumilus, pueden reconocer de forma cruzada antígenos de Neisseria meningitidis, contribuyendo a generar una inmunidad “adicional”. Otros anticuerpos dirigidos contra otras especies bacterianas potencialmente patógenas como Escherichia coli K1, también contribuyen a formar más anticuerpos anti-polisacárido capsular del serogrupo B, y en el caso de Escherichia coli K92, los anticuerpos generados van dirigidos más hacia el serogrupo C(5).
Mecanismos de evasión empleados por el meningococo
Ante esta andanada de mecanismos defensivos empleados por el sistema inmunitario frente al meningococo, este ha desarrollado a su vez una serie de estrategias para evadir dichas respuestas con objeto de asegurar su supervivencia. Entre estas estrategias están las siguientes:
- Incremento de cápsula. Una vez el meningococo alcanza la luz vascular, comienza a inducir el crecimiento de su cápsula. Esto conforma una barrera física y química que intenta dificultar tanto los mecanismos de fagocitosis, como la acción de los anticuerpos(6).
- “Ocultamiento” dentro de las células endoteliales. Durante su proceso de invasión sanguínea, algunos meningococos son capaces de penetrar dentro de las células endoteliales del haz vascular, manteniéndose por lo tanto a salvo de la acción tanto de fagocitos, como de anticuerpos y proteínas del complemento(7).
- Variación de fase. La presión ejercida por el sistema inmunitario puede hacer que algunas bacterias sean capaces de cambiar, en algunos casos, y no expresar en otros, ciertos antígenos de superficie y entre ellos producir cambios mayores como, por ejemplo, un cambio de cápsula(8).
- Producción de “IgAsas”. Algunas cepas especialmente virulentas pueden producir proteasas que destruyen anticuerpos como la IgA(9).
Predisposición genética
Las últimas investigaciones en la genética de la infección por meningococo han demostrado que existen ciertas variaciones en genes reguladores de la activación del complemento, sobre todo del factor H, que juegan un papel muy importante en la aparición de la enfermedad invasora versus la colonización asintomática por esta bacteria(10).
Respuesta inmune, edad e infección meningocócica
No existe un periodo de tiempo más delicado para padecer enfermedades infecciosas en un niño como el que transcurre desde su nacimiento hasta que cumple los 4 o 5 años de vida
No existe un periodo de tiempo más delicado para un niño como el que transcurre desde su nacimiento hasta que cumple los 4 o 5 años de vida. Este periodo eleva de forma importante el riesgo de padecer enfermedades infecciosas en general y EMI en particular. Y es que cuando un niño nace, ciertos mecanismos inmunitarios todavía se encuentran en una fase de inmadurez importante, lo que contribuye a la instauración de forma más frecuente y seria de infecciones frente a las cuales pueden no hacerse respuestas inmunitarias del todo efectivas. Algunos datos que definen esta inmadurez son los siguientes:
- Defectos funcionales de fagocitosis.
- Deficiencia de proteínas del complemento, llegando como mucho a porcentajes del 50% del adulto, aunque para fracciones “terminales” como la C8 y C3 pueden llegar a ser solo del 28% y 10% respectivamente. A esto le podemos sumar otros como la caída de anticuerpos maternos transferidos a través de la placenta que experimenta el lactante a los 3-6 meses de edad (Figura 1).
La IgG2 es un anticuerpo que principalmente nos defiende de los microorganismos capsulados como meningococos, neumococos o Haemophilus.
Se suele transferir de forma defectuosa a través de la placenta, existiendo algunas situaciones maternas que pueden incluso disminuir todavía más esta transferencia
La IgG2 es un anticuerpo que principalmente nos defiende de los microorganismos capsulados como meningococos, neumococos o Haemophilus. A diferencia de otras subclases de inmunoglobulinas como la IgG1 o IgG3, actualmente sabemos que la IgG2 se suele transferir de forma defectuosa a través de la placenta(11), existiendo algunas situaciones maternas que pueden incluso disminuir todavía más si cabe esta transferencia(12). Por ejemplo, se ha comprobado que las mujeres gestantes positivas a VIH transfieren de forma defectuosa todas las inmunoglobulinas y todavía peor la IgG2. Otras situaciones como la existencia de un estado de hipergammaglobulinemia (>15g/L) en la madre, puede inducir una “sobresaturación” de receptores placentarios para la IgG, no permitiendo el paso adecuado de estos anticuerpos. También se ha comprobado que el parásito Plasmodium falciparum es capaz de alterar y hacer desaparecer los receptores de IgG a nivel placentario. Todas estas situaciones se traducen en una falta parcial o total de transferencia inmunoglobulínica materna, lo que pone al neonato en una seria situación de indefensión, incrementando el riesgo de infección neonatal, y en particular por gérmenes capsulados. Por si esto no fuese suficiente, los recién nacidos y niños menores de 2 años no son capaces de producir de forma adecuada IgG2, lo que conlleva que no van a ser capaces de desarrollar respuestas del todo adecuadas frente a estas bacterias capsuladas(13).
La inmunosenescencia, determina una menor capacidad de respuesta a gérmenes capsulados como neumococos y meningococos, así como una menor respuesta efectiva a las vacunas que previenen estas y otras infecciones
Aunque se habla y escribe bastante menos de ello, no debemos olvidar que los ancianos son personas altamente susceptibles de padecer una EMI con alta tasa de letalidad. La inmunosenescencia, definida como el estado de desregulación de la función inmune que contribuye a un aumento de susceptibilidad de los ancianos a la infección, la enfermedad autoinmune y al cáncer, determina una menor capacidad de respuesta a gérmenes capsulados como neumococos y meningococos, así como una menor respuesta efectiva a las vacunas que previenen estas y otras infecciones(14). Son muchos los cambios asociados a este estado inmunosenescente, destacando entre ellos una producción de anticuerpos disminuida en cantidad y no infrecuentemente también disminuida en cuanto a su funcionalidad.
Factores de “riesgo inmunológico” en la infección meningocócica
Además de las ya vistas particularidades y características inmunológicas asociadas a la edad, existen otras situaciones que se pueden asociar con una mala respuesta a la infección en general y a un incremento del riesgo de EMI en particular:
Actualmente algunos expertos consideran que la EMI puede ser la primera y única señal de una posible inmunodeficiencia
- Pacientes con Inmunodeficiencias. Tanto las inmunodeficiencias primarias y secundarias que afectan a la producción de anticuerpos (inmunodeficiencia variable común –IDVC-, enfermedad de Bruton, etc), como sobre todo los déficits de proteínas del complemento(15), constituyen factores de riesgo para la EMI. Actualmente algunos expertos consideran que la EMI puede ser la primera y única señal de una posible inmunodeficiencia. Hasta un 47% de los pacientes con deficiencia de complemento, puede padecer una EMI, presentando con mayor frecuencia complicaciones más graves (>25%), que los pacientes sin deficiencias del complemento (3,3%).
- Asplenia/hiposplenia. Aparte de la asplenia congénita y la esplenectomía que incrementan de forma considerable el riesgo de EMI, algunas enfermedades que cursan con hipoesplenismo funcional como es el caso de los pacientes afectados por malaria o anemia falciforme, hacen que el riesgo de padecer una EMI se multiplique de forma muy importante. La anemia falciforme, por ejemplo, incrementa el riesgo de padecer una EMI o una ENI (enfermedad neumocócica invasiva) cientos de veces(16).
- Pacientes sometidos a terapia biológica con Eculizumab. Este anticuerpo monoclonal se encuentra destinado al tratamiento de pacientes que padecen hemoglobinuria paroxística nocturna, síndrome hemolítico urémico atípico, miastenia gravis y TENMO (trastorno del espectro de neuromielitis óptica). El mecanismo de acción de Eculizumab se basa en su capacidad de bloquear la formación del complejo de ataque a membrana (MAC) producido en la cascada del complemento. Esto evidentemente conlleva un incremento muy importante de infecciones por bacterias como el meningococo (riesgo multiplicado por 1000 o 2000), incluso en individuos vacunados(17)
(Figura 2). - Pacientes sometidos a quimioterapia. Un estudio demostró que de los niños sometidos a quimioterapia por leucemia y prevacunados frente a meningococo C, solo el 17% presentó títulos protectores(18). La respuesta de los pacientes a la vacunación frente a la vacuna conjugada de meningococo C, se ha demostrado variable y dependiente de la proximidad a la quimioterapia y del número total de linfocitos B(19).
La anemia falciforme, incrementa el riesgo de padecer una EMI o una ENI (enfermedad neumocócica invasiva) cientos de veces
Vacunación frente a meningococo
Vacunación frente a los serogrupos ACWY
Tipos de vacunas
En base a su composición vamos a tener dos tipos de vacunas:
- Vacunas polisacarídicas. Son vacunas adyuvantadas, formuladas y compuestas exclusivamente por polisacáridos pertenecientes a los distintos serogrupos. Suelen producir respuestas no muy intensas y de corta duración. Los anticuerpos producidos por estas vacunas muestran normalmente baja afinidad (potencia de unión del anticuerpo al antígeno), y avidez (número de puntos de unión del anticuerpo al antígeno), aún en administraciones repetidas.
- Vacunas conjugadas. Son también vacunas adyuvantadas, donde los antígenos polisacarídicos son “ensamblados” con diversas proteínas o carriers, entre las que destacan el toxoide diftérico, toxoide tetánico y el CRM197 (un mutante no tóxico de la toxina diftérica). Estas vacunas conjugadas inducen anticuerpos con mayor afinidad y avidez, con respuestas más intensas y de más larga duración que las vacunas no conjugadas.
Las vacunas conjugadas inducen anticuerpos con mayor afinidad y avidez, con respuestas más intensas y de más larga duración que las vacunas no conjugadas
Vacunación frente al serogrupo B
Las vacunas usan antígenos subcapsulares del meningococo. Entre ellos destaca el fHbP (Factor H Binding Proteín), una proteína empleada por el meningococo para hacerse con el factor H plasmático del hospedador infectado, con objeto de aprovechar su principal acción; la de bloquear la activación de cascada del complemento
La razón por la que no se emplea el polisacárido capsular del serogrupo B para la fabricación de vacunas, como las del resto de serogrupos, tiene su explicación en la composición química de dicho polisacárido. La cápsula del meningococo serogrupo B está formada principalmente por ácido siálico, el cual es pobremente inmunogénico. De hecho, el ácido siálico es un componente importante de las células nerviosas por lo que el sistema inmunitario ha aprendido a “tolerarlo” sin desarrollar ninguna respuesta frente al mismo. Además si esta tolerancia se perdiese, existiría el peligro potencial de producir, a través de la vacunación con este polisacárido, una respuesta cruzada de anticuerpos que pudiesen dirigir el ataque al tejido nervioso con el consiguiente riesgo de desarrollar una respuesta patológica de tipo autoinmune. Debido a esto se ha hecho necesario fabricar estas vacunas con otros antígenos, principalmente proteínas subcapsulares, que se encuentran localizados en la membrana plasmática bacteriana. Entre estos antígenos proteícos destaca el fHbP (Factor H Binding Proteín), una proteína empleada por el meningococo para hacerse con el factor H plasmático del hospedador infectado, con objeto de aprovechar su principal acción; la de bloquear la activación de cascada del complemento. Dentro de estas fHbP se han descrito dos subfamilias (A y B), que muestran alrededor de un 60%-75% de homología(20). Las vacunas que incluyen este antígeno median la producción de anticuerpos con actividad bactericida.
Tipos de vacunas
Actualmente están comercializadas dos vacunas frente al serogrupo B. Ambas incluyen la proteína fHbP en su composición:
- Bexsero® (Laboratorio GSK). Vacuna compuesta por cuatro proteínas (4CMenB) (Figura 3), obtenidas mediante lo que se ha venido en llamar vacunología inversa, la cual está basada en la identificación de componentes del patógeno que tienen mayor probabilidad de ser inmunógenos. Dentro de la fHbP se incluye una de la subfamilia B no lipidada. Al estar compuesta por cuatro antígenos diferentes, se ha podido demostrar la acción sinérgica entre los mismos lo que le confiere una amplia protección(21), además de minimizar la posibilidad de aparición de mutantes defectivos para alguna de las proteínas, el cual podría estar cubierto por las otras presentes(22).
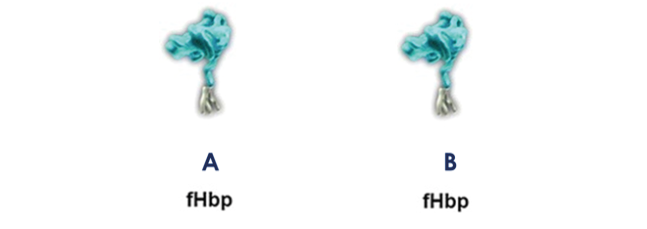
- Trumenba® (Laboratorio Pfizer). Esta vacuna incluye dos proteínas, ambas pertenecientes a las subfamilias A y B del fHbp (MenB-fHbp) (Figura 4). Estas proteínas fHbP se encuentran lipidadas. La lipidación de proteínas es una técnica que contribuye a elevar la inmunogenicidad de los antígenos empleados en cualquier vacuna(22).
No cabe duda de que el futuro que nos depara el conocimiento inmunológico aplicado a las vacunas será sorprendente, ya no solo por la aparición de más y mejores vacunas destinadas a la prevención de las enfermedades a las que van destinadas, sino por otros efectos en los que acabamos de abrir una senda como son los llamados efectos inespecíficos o heterotípicos de algunas vacunas que, en un futuro no muy lejano, nos sorprenderá con nuevos y apasionantes descubrimientos y aplicaciones. Mientras tanto, sigamos vacunando, porque las vacunas SALVAN VIDAS.
Tablas y figuras
Figura 1. Características inmunológicas del neonato

Figura 2. Acción de Eculizumab sobre la cascada del complemento y el complejo de ataque a membrana
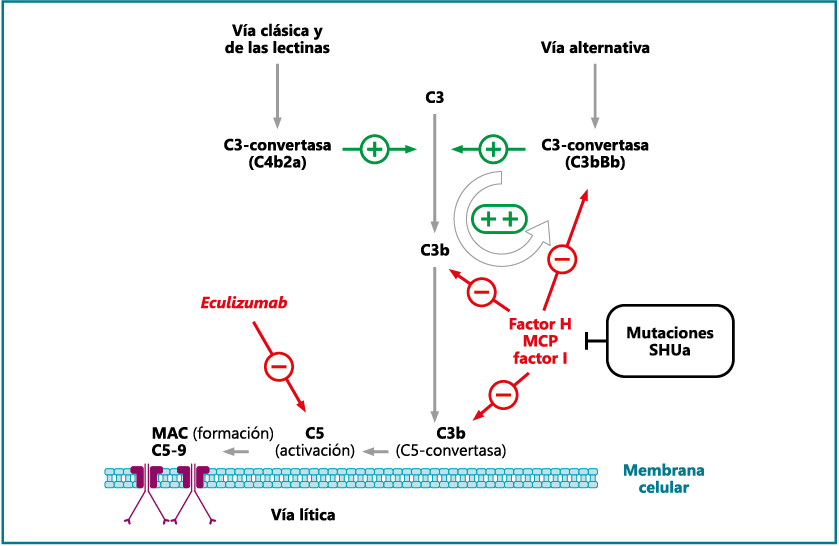
Figura 3. Proteínas constituyentes de la vacuna Bexsero
Figura 4. Proteínas constituyentes de Trumenba. Ambas proteínas se encuentran lipidadas
Bibliografía
- Weyand N.J. Neisseria models of infection and persistence in the upper respiratory tract. Path Dis, Volume 75, Issue 3, April 2017, ftx031.
- Waage A, Halstensen A, Shalaby R, Brandtzaeg P et al. Local production of tumor necrosis factor alpha, interleukin 1, and interleukin 6 in meningococcal meningitis. Relation to the inflammatory response. J Exp Med. 1989 Dec 1; 170(6):1859-67.
- Arcavi L, Benowitz N.L. Cigarette Smoking and Infection. Arch Intern Med. 2004; 164(20):2206-2216.
- Sikkema D.J, Friedman K.E, Corsaro B, Kimura A, et al. Relationship between Serum Bactericidal Activity and Serogroup-Specific Immunoglobulin G Concentration for Adults, Toddlers, and Infants Immunized with Neisseria meningitidis Serogroup C Vaccines. Clin Diagn Lab Immunol. 2000 Sep; 7(5): 764–768.
- Rosenstein NE, Perkins BA, Stephens DS, Popovic T, Hughes JM. Meningococcal disease. N Engl J Med 2003, 344(18):1378-1388.
- Pizza M.G, Rappuoli R. Neisseria meningitidis: pathogenesis and immunity. C Op Microbiol. Volume 23, February 2015: 68-72.
- Unkmeir A, Latsch K, Dietrich G et al. Fibronectin mediates Opc-dependent internalization of Neisseria meningitidis in human brain microvascular endothelial cells. Mol Microbiol 2002;46:933–46.
- Hammerschmidt S, Müller A, Sillmann H, Mühlenhoff M, et al. Capsule phase variation in Neisseria meningitidis serogroup B by slipped-strand mispairing in the polysialyltransferase gene (siaD): correlation with bacterial invasion and the outbreak of meningococcal disease. Mol Microbiol. 1996 Jun;20(6):1211-20.
- Besbes A, Le Goff S, Antunes A, Terrade A, et al. Hyperinvasive Meningococci Induce Intra-nuclear Cleavage of the NF-κB Protein p65/RelA by Meningococcal IgA Protease. PLoS Pathog 2015. 11(8): e1005078.
- Martinón-Torres F, Png E, Khor CC, Davila S, Wright VJ, Sim KS, et al. Natural resistance to Meningococcal Disease related to CFH loci: Meta-analysis of genome-wide association studies. Sci Rep. 2016 Nov 2;6:35842.
- Wilcox C.R, Holder B, Jones C.E. Factors Affecting the FcRn-Mediated Transplacental Transfer of Antibodies and Implications for Vaccination in Pregnancy. Front Immunol 2017. 8:1294.
- Fouda G.G, Martinez D.R, Swamy G.K, Permar S.R. The Impact of IgG Transplacental Transfer on Early Life Immunity. Immuno Horizons 2018, 2 (1) 14-25.
- Klouwenberg P.K, Bont L. Neonatal and Infantile Immune Responses to Encapsulated. Bacteria and Conjugate Vaccines. Clin Dev Immunol. Volume 2008, Article ID 628963, 10 pages.
- Trzewikoswki de Lima G, De Gaspar E. Study of the Immune Response in the Elderly: Is It Necessary to Develop a Vaccine against Neisseria meningitidis for the Aged? J Aging Res. Volume 2019, Article ID 9287121, 8 pages.
- Ladhani S.N, Campbell H, Lucidarme J, Gray S, et al. Invasive meningococcal disease in patients with complement deficiencies: a case series (2008–2017). BMC Infect Dis. 2019; 19: 522.
- Bootha c, Inusa B, Obaroc S.K. Infection in sickle cell disease: A review. Int J Infect Dis. Volume 14, Issue 1, January 2010, Pages e2-e12.
- McNamara L.A, Topaz N, Wang X, Hariri S. High Risk for Invasive Meningococcal Disease Among Patients Receiving Eculizumab (Soliris) Despite Receipt of Meningococcal Vaccine. MMWR Morb Mortal Wkly Rep. 2017 Jul 14; 66(27): 734–737.
- Patel SR, Ortín M, Cohen BJ, Borrow R, et al. Revaccination of children after completion of standard chemotherapy for acute leukemia. Clin Infect Dis. 2007 Mar 1;44(5):635-42.
- Yu JW, Borkowski A, Danzig L, Reiter S, Kavan P, Mazer BD.. Immune response to conjugated meningococcal C vaccine in pediatric oncology patients. Pediatr Blood Cancer 2007; 49:918-23.
- Murphy E, Andrew L, Lee KL, et al. Sequence diversity of the factor H binding protein vaccine candidate in epidemiologically relevant strains of serogroup B Neisseria meningitidis. J Infect Dis. 2009;200:379–389.
- Giuliani M, Bartolini E, Galli B, Santini L, et al. Human protective response induced by meningococcus B vaccine is mediated by the synergy of multiple bactericidal epitopes. Sci Rep 2018: 8:3700.
- Toneatto D, Pizza M, Masignani V, Rappuoli R. Emerging experience with meningococcal serogroup B protein vaccines, Exp Rev Vaccines, 2017.16:5, 433-451.
- Zeng W, Eriksson E.M, Lew A, Jackson DC. Lipidation of intact proteins produces highly immunogenic vaccine candidates. Mol Immunol. 2011 Jan;48(4):490-496.




