Hirsutismo. Enfoque diagnóstico y terapéutico
Hirsutismo. Enfoque diagnóstico y terapéutico
L. Forga Llenas. Servicio de Endocrinología y Nutrición. Complejo Hospitalario de Navarra. Pamplona. Profesor Clínico sociado de Medicina Interna de la Facultad de Medicina de la Universidad de Navarra.
Adolescere 2021; IX (2): 138-146
Resumen
|
El hirsutismo se define como una cantidad anormal de vello en la mujer, con un patrón de distribución masculino. En la adolescente, el exceso de vello, más allá de la repercusión psicológica, es también un indicador potencial de un hiperandrogenismo subyacente, que puede requerir tratamiento específico y puede tener distintas implicaciones para la fertilidad, el consejo genético y la aparición de futuras patologías. La etiología más frecuente es la poliquistosis ovárica, cuyo diagnóstico es controvertido. Presentamos un caso clínico de hirsutismo y discutimos el enfoque diagnóstico y terapéutico a que da lugar. Palabras clave: Hirsutismo; Síndrome de ovario poliquístico; Insulín-resistencia. |
Abstract
|
Hirsutism is defined as an abnormal amount of hair in women, with a male pattern of distribution. In adolescents, excess hair, beyond the psychological repercussions, is also a potential indicator of an underlying hyperandrogenism, which may require specific treatment and may have different implications for fertility, genetic counseling and the appearance of future pathologies. The most common etiology is polycystic ovarian syndrome, the diagnosis of which is controversial. We present a clinical case of hirsutism and discuss the diagnostic and therapeutic approach to it. Key words: Hirsutism; Polycystic ovary syndrome; Insulin resistance. |
Introducción
El hirsutismo se define como una cantidad anormal de vello en la mujer, con un patrón de distribución masculino
El hirsutismo afecta al 5-10% de las mujeres premenopáusicas. Se define como una cantidad anormal de vello en la mujer, con un patrón de distribución masculino(1). El crecimiento del vello sexual madura a través de la pubertad hasta alcanzar el pico más o menos dos años después de la menarquia, aproximadamente a los 15 años(2). En la evaluación clínica del hirsutismo, conviene distinguir la afección que representa de la aflicción que supone. Aunque no es la única manera, su intensidad se evalúa, habitualmente, mediante la escala de Ferriman y Gallwey que cuantifica la extensión del crecimiento del vello en las áreas más sensibles a los andrógenos. En 1961 Ferriman DF y Gallwey D, en un estudio en el que incluyeron a mujeres a partir de los 15 años (motivo por el que se cuestiona su uso en adolescentes), describieron la gradación del vello entre 1 y 4 puntos, en once zonas del cuerpo femenino(3) (Tabla I). Posteriormente, Hatch et al en 1981, redujeron la evaluación inicial, pasando de 11 a 9 localizaciones, descartando el antebrazo y la pierna, que es la que se utiliza habitualmente. Consideramos que existe hirsutismo cuando la puntuación en la escala de Ferriman y Gallwey llega, al menos a los 8 puntos, aunque esta puntuación debería variar con la raza, ya que no es lo mismo en población asiática (generalmente con menos vello) que en mediterránea (generalmente con más vello). De hecho, en mujeres mediterráneas se recomienda considerar hirsutismo con una puntuación ≥10(1). En la práctica es muy frecuente encontrarse en la consulta con pacientes que acuden por presentar áreas localizadas de crecimiento excesivo de vello sexual, de carácter masculino (facial, en mentón, mejillas o labio superior). En estos casos, la puntuación en la escala de Ferriman y Gallwey suele ser normal y se define como hirsutismo focal(2). Por otra parte, a menudo las mujeres se han depilado, siquiera sea parcialmente, poco antes de la consulta, por lo que la puntuación según la escala de Ferriman y Gallwey es, en la práctica, notablemente imprecisa. Finalmente, debemos distinguir el hirsutismo de la hipertricosis, que consiste en un crecimiento de vello difuso, generalizado, con un patrón no sexual, debido a una predisposición genética o a medicaciones del tipo de la fenitoína o ciclosporina(2). También puede observarse un crecimiento difuso del vello en situaciones como la anorexia o una pérdida importante de peso(4). La adolescencia, entendida tal como la define la OMS, como el período comprendido entre los 10 y 19 años, comporta importantes problemas adicionales para el diagnóstico(5).
En la evaluación clínica del hirsutismo, conviene distinguir la afección que representa de la aflicción que supone, mediante la escala de Ferriman y Galwey
Debemos distinguir el hirsutismo de la hipertricosis, que consiste en un crecimiento de vello difuso, generalizado, con un patrón no sexual, debido a una predisposición genética o a medicaciones
En este artículo presentamos y debatimos el caso de una paciente que consulta, en la adolescencia, por hirsutismo y alteraciones menstruales. Y planteamos la discusión con un enfoque diagnóstico y terapéutico, centrándonos en las causas más frecuentes.
Caso clínico
Anamnesis
Mujer de 15 años de edad que consulta, remitida por su ginecólogo, por hirsutismo. Refiere exceso de vello generalizado desde la infancia, aunque acentuado desde la menarquia, coincidiendo con la aparición de acné. Menarquia a los 12 años, con menstruaciones irregulares, (una más o menos cada 2 meses). En el último año ha tenido un período de 6 meses de amenorrea. No galactorrea. Sigue una alimentación normal y practica solo el ejercicio físico del colegio. No toma ninguna medicación habitual ni productos de herboristería.
Antecedentes personales: sin alergias conocidas. Intervenida quirúrgicamente de otitis y adenoidectomía.
Antecedentes familiares: bisabuela y un primo materno con Diabetes tipo 2.
Exploración física
Peso: 58 Kg; Talla: 161 cms; IMC: 22; TA: 100/60; FC: 78 x’.
Normoconstituida. Buen color de piel y mucosas. No bocio. ACP: normal. No acantosis nigricans.
Hirsutismo (escala de Ferriman y Gallwey): 1+1+1+1+2+2+2+1+3 = 14 puntos.
Informe que aporta de Ginecología: Exploración ginecológica normal. Ecografía transabdominal: compatible con síndrome de ovario poliquístico (SOP).
Exploraciones complementarias
Hemograma: Normal.
Srm. Glucosa: 96 mg/dl, Colesterol total: 138 mg/dl, HDL-colesterol: 71 mg/dl, Triglicéridos: 42 mg/dl, LDL-colesterol: 59 mg/dl (calculado); Urato: 3,7 mg/dl, Creatinina: 0,8 mg/dl, Fe: 66 μg/dl, Ferritina: 30,4 ng/ml, ASAT: 22 U/L, ALAT: 26, TSH: 2,79 μUI/ml, FSH: 3,6 mUI/ml, LH: 14,7 mUI/ml, cociente LH/FSH: 4, Estradiol: 88 pg/ml (VN fase folicular: 19-246), Progesterona: 1,16 ng/ml (VN fase folicular: 0,15-1,4), Testosterona libre: 3,6 ng/l (VN: 0,1-2,6), Androstendiona: 5,3 μg/l, (VN: 0,4-2,7), DHEA-S: 186 μg/dl (VN: 145-395), PRL: 12,7 ng/ml, Cortisol: 24,5 μg/dl, 17-OH-Pg: 0,9 ng/ml, Insulina: 61,8 μU/ml (VN: 2-17), Índice de resistencia insulínica (HOMA): 13,1 (VN: 0-3,4).
Orina 24 horas: Cortisol libre: 36 μg/24 h (VN: 4-176).
Diagnóstico diferencial
El diagnóstico diferencial del hirsutismo en la adolescencia incluye, entre sus causas más frecuentes:
- Hirsutismo idiopático
- SOP
- Hiperplasia suprarrenal congénita, en forma no clásica (HSCNC)
- Síndrome de Cushing
- Hiperprolactinemia
- Tumores virilizantes
- Hipotiroidismo
- Yatrogenia
La paciente no tomaba ningún fármaco, por lo que se descartó la yatrogenia. Por otra parte, los valores normales de prolactina, TSH y de 17 hidroxi-progesterona descartaban hiperprolactinemia, hipotiroidismo e hiperplasia suprarrenal congénita respectivamente. No había datos clínicos que acompañaran la sospecha de hipercortisolismo. Se detectó hiperandrogenismo, pero los valores no estaban suficientemente elevados como para considerar un tumor virilizante. Por otra parte, el cuadro clínico, los datos analíticos (andrógenos, gonadotrofinas y resistencia a la insulina, aun con sus limitaciones como elementos diagnósticos) y la ecografía ginecológica, eran muy sugestivos de un SOP.
Juicio clínico
SOP.
Tratamiento
Régimen de vida: se le recomienda practicar ejercicio físico diario con objeto de mejorar la sensibilidad a la insulina.
Régimen de alimentación: normal, evitando hidratos de carbono refinados.
Metformina 1000 mg: empezará tomando medio comprimido con la cena, diariamente. Si lo tolera bien, a la semana, pasará a tomar 1 comprimido, diariamente, con la cena, hasta volver a revisión.
Diane 35 (35 μg de etinil-estradiol más 2 mg de acetato de ciproterona): tomará 1 comprimido con el desayuno, diariamente siguiendo las instrucciones del prospecto.
Evolución
La paciente toleró mal la metformina. Tras varios intentos, aumentando progresivamente la dosis, consiguió tomar 1 comp/día de Metformina 850 mg. El índice HOMA descendió, en su valor más bajo, a 5. Posteriormente, a los 8 años de seguimiento, se sustituyó Metformina por pioglitazona 30 mg. La tolerancia gastrointestinal fue buena, pero presentó retención hídrica y el índice HOMA aumentó a 10,4. Con Diane 35, las reglas se normalizaron. Al cabo de 3 años -con 18 años- se hizo la prueba de suspender Diane y la paciente presentó amenorrea, por lo que retomó ACO, en esta ocasión con Yasmin (Etinil-estradiol 30 μg con drospirenona 3 mg). Desde las primeras visitas de seguimiento, los valores de Testosterona libre y de Androstendiona se normalizaron (0,1 ng/l y 2,1 μg/l, respectivamente). La puntuación del hirsutismo descendió a 7 puntos a los 4 años de tratamiento (aunque se había tratado, además, con fotodepilación con láser).
A lo largo de los 10 años de seguimiento, se le han practicado 3 ecografías más en sus visitas al ginecólogo, la última hace 1 año y las 2 últimas, transvaginales. Las descripciones no han sido precisas, pero se ha mantenido el término “ovarios multiquísticos”.
Discusión
Enfoque diagnóstico
El diagnóstico de una paciente con hirsutismo es un recorrido con algunos recovecos. No es infrecuente, por tanto, que la impresión diagnóstica inicial no se sostenga en el tiempo
El diagnóstico de una paciente con hirsutismo es un recorrido con algunos recovecos. No es infrecuente, por tanto, que la impresión diagnóstica inicial no se sostenga en el tiempo.
Casi la mitad de las mujeres con leve exceso de vello tiene hirsutismo idiopático. Cuando el hirsutismo es más intenso, este porcentaje disminuye a <20%(2). El diagnóstico de hirsutismo idiopático se establece cuando, a pesar del exceso de vello, las concentraciones de andrógenos séricos son normales, la función ovulatoria es normal y se han descartado otras causas de hirsutismo(4). Aquí hay que tener en cuenta que una historia de menstruaciones regulares no es suficiente para excluir disfunción ovárica, ya que hasta el 40% de las mujeres eumenorreicas son anovulatorias(6).
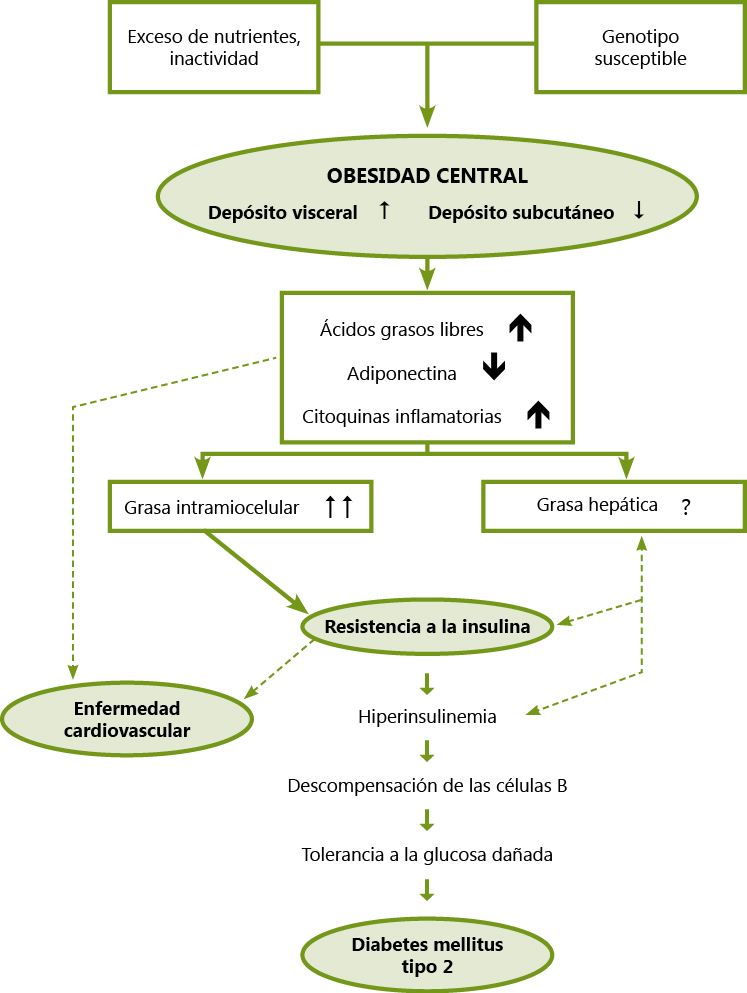
Se cree que, el hirsutismo idiopático, se debe a un incremento primario en la actividad de las dos isoenzimas 5-α-reductasa (tipo 1 y tipo 2) junto con una posible alteración en la función del receptor de los andrógenos. Un número de investigadores han sugerido que los niveles de 3 alfa diol glucurónido pueden servir como marcador de actividad 5 alfa reductasa. Sin embargo, los niveles en suero de este conjugado no dependen solamente de la actividad en piel de 5 alfa reductasa, sino también de los niveles circulantes de precursores androgénicos. Evidentemente son necesarios estudios sobre la genética molecular y los aspectos metabólicos de estas pacientes para conocer mejor esta patología(7).
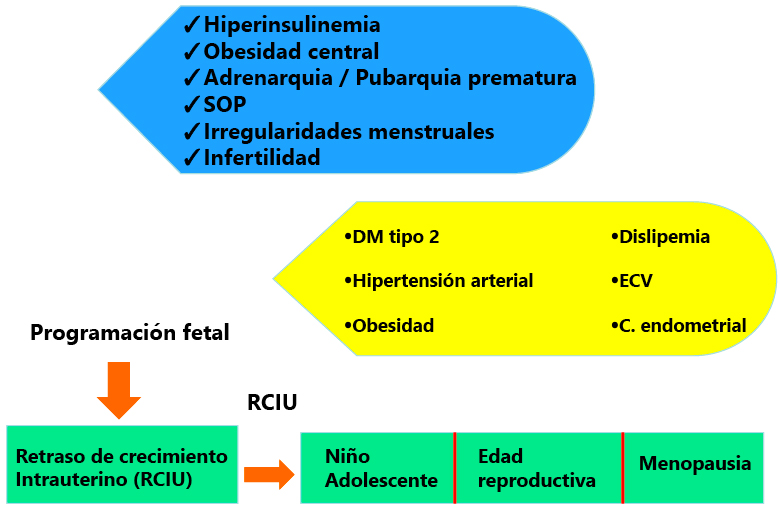
El SOP afecta al 6-10% de mujeres en edad reproductiva y es la causa más común de hirsutismo en la adolescencia. Su fisiopatología altamente compleja, su presentación clínica variable y la falta de suficientes datos basados en la evidencia, hacen que coincidan varias guías en cuanto a su diagnóstico. Existe, no obstante, un consenso en que este síndrome se caracteriza por hiperandrogenismo y disfunción ovárica, de tal modo que los principales datos incluyen irregularidad menstrual, oligo-anovulación, infertilidad, hirsutismo, acné y morfología ovárica poliquística en la ecografía(8). Los últimos criterios para el diagnóstico de SOP, basados en los criterios de Rotterdam de 2003 y puestos al día en 2012 por el NIH, consideran que deben darse dos de tres características (hiperandrogenismo, oligo-anovulación, y morfología de ovario poliquístico), tras haber excluido otros diagnósticos causales. Comprenden 4 posibilidades fenotípicas según la paciente tenga: A) las 3 características; B) hiperandrogenismo y oligo-anovulación; C) hiperandrogenismo y morfología de ovario poliquístico y D) oligo-anovulación y morfología de ovario poliquístico(8). Casos más graves dentro del espectro clínico del SOP lo constituyen la hipertecosis y el síndrome HAIR-AN (con extrema insulin-resistencia)(9).
El SOP afecta al 6-10% de mujeres en edad reproductiva y es la causa más común de hirsutismo en la adolescencia
Definir este síndrome en adolescentes, es más complicado todavía, puesto que la mayoría de los síntomas forman parte del desequilibrio hormonal fisiológico durante la pubertad(8). En concreto, aproximadamente el 75% de las adolescentes presentan ciclos de entre 21 y 45 días de duración durante el primer año post-menarquia y los ciclos no suelen normalizarse hasta 2-3 años después de la menarquia. No obstante, cuando el período de tiempo entre las menstruaciones es tan corto como <19 días o tan largo como >90 días, el diagnóstico de SOP es más probable. En la Tabla II se muestran las irregularidades menstruales que pueden ayudar al diagnóstico de SOP(5). Por otra parte, en la ecografía, no solo el volumen de los ovarios en adolescentes es mayor que en mujeres adultas, sino que, además, una cuarta parte de las chicas adolescentes muestran múltiples folículos ováricos(5). Por este motivo, las características de la ecografía ovárica pierden valor en las mujeres adolescentes, a menos que el volumen de cada ovario sea ≥10-12 ml y el número de folículos sea ≥12 (incluso 20 según algunos autores), con un diámetro de 2-9 mms(8). Una reciente Guía internacional(5), es más radical y no recomienda la ecografía pélvica para el diagnóstico del SOP en los 8 primeros años tras la menarquia. Y, si se ha establecido el diagnóstico de SOP, aconseja reevaluar a la paciente a los 3 años post-menarquia en cuanto a las irregularidades menstruales -dejando sin tratamiento durante 3 meses(10)-, y practicando nueva ecografía pélvica a los 8 años post-menarquia. Para tratar de conciliar los distintos puntos de vista, un consorcio internacional de Sociedades de Endocrinología Pediátrica ha sugerido unos criterios específicos para el diagnóstico de SOP en la adolescencia (Tabla III)(6) y Fruzzetti F y colbs.(11) han publicado recientemente un estudio en mujeres mediterráneas en el que señalan que los criterios de Rotterdam son válidos también en adolescentes, por lo menos en aquellas que tenían la regla desde hacía al menos 2 años. A pesar de estos intentos, persisten las dudas diagnósticas, sobre todo en los 2 primeros años tras la menarquia.
Completando el espectro clínico del SOP, las alteraciones menstruales reflejan anovulación, por lo que las pacientes pueden tener dificultades para concebir (lo que no significa que vayan a tenerlas obligatoriamente) o llevar el embarazo a término (la frecuencia de abortos es del 30-50%)(8).
Dada la dificultad diagnóstica, para aquellas adolescentes que tienen datos de SOP, pero que no cumplen los criterios exigidos, se ha creado la categoría de “en riesgo” de SOP
Dada la dificultad diagnóstica, para aquellas adolescentes que tienen datos de SOP, pero que no cumplen los criterios exigidos, se ha creado la categoría de “en riesgo” de SOP. En estos casos se aplica tratamiento sintomático y se practican evaluaciones regulares(2,5).
A nivel bioquímico, y antes la sospecha de hiperandrogenismo, deben medirse los andrógenos circulantes, especialmente testosterona total y libre. La androstendiona es también muy útil, ya que suele estar elevada con frecuencia similar a la testosterona(5). A destacar que, antes del año 2000, se afirmaba que un tercio de los pacientes con SOP mostraban hiperprolactinemia, sin tratarse de prolactinomas. Hoy en día, esto se considera un mito. No obstante, en nuestra experiencia, es frecuente encontrar valores elevados de Prolactina, aunque <100 ng/ml, a diferencia del prolactinoma, en cuyo caso los niveles de prolactina suelen ser > 200 ng/ml.
Por último, los aspectos fisiopatológicos complejos antes mencionados incluyen insulin-resistencia, por lo que es útil medir insulina y glucemia, calculando el índice HOMA. Este punto es importante ya que la resistencia a la insulina contribuye al incremento del riesgo de desarrollar obesidad, diabetes tipo 2, enfermedad cardiovascular y alteraciones neuropsicológicas(6).
La HSCNC se presenta en el 0,1 a 0,2% de la población caucásica y en el 4,2% de mujeres con hiperandrogenismo(1). Se debe a mutaciones en los genes que codifican enzimas implicados en la esteroidogénesis adrenal, habitualmente la 21-hidroxilasa. Mutaciones en el gen CYP21A2 causa un bloqueo en la producción de cortisol y un exceso de hormonas sexuales, sobre todo precursores androgénicos(4).
El diagnóstico se confirma cuando los niveles circulantes de 17-hidroxiprogesterona, en la fase folicular del ciclo menstrual, son >5 ng/ml o >12 ng/ml en respuesta a la estimulación con ACTH. Cualquier valor <2 ng/dl, lo excluye(5). El diagnóstico diferencial entre HSCNC y SOP en ocasiones es muy complicado, ya que pueden coexistir ambas patologías, bien en paralelo o con una alteración innata de la esteroidogénesis adrenal como causa primaria y, como consecuencia del ambiente hiperandrogénico, aparece secundariamente el SOP(12).
Los tumores ováricos o adrenales productores de andrógenos suponen raras causas de hirsutismo (0,2% de mujeres con hiperandrogenismo). La mitad son malignos(1). Solo el 10% de tumores ováricos se presentan con exceso de producción de hormonas sexuales. Estos tumores generalmente segregan testosterona y, a veces, androstendiona y estrógenos. Los niveles de testosterona pueden estar en rango masculino, por ello, se presentan clínicamente con signos y síntomas de hiperandrogenismo severos y de instauración rápida. El hirsutismo suele acompañarse de alopecia de patrón masculino, atrofia mamaria, clitoromegalia y voz más grave. Distinguir un tumor de una hipertecosis ovárica (una forma de SOP con más hiperandrogenismo), es difícil, a menos que una ecografía transvaginal muestre una tumoración ovárica. También pueden coexistir tumores ováricos con SOP(9).
Los tumores adrenales segregan cortisol o DHEAS, pero raramente producen testosterona. Su presencia sugiere carcinoma adrenal(4).
Diagnóstico diferencial
El diagnóstico diferencial se resuelve con la clínica y las exploraciones complementarias. No se recomienda aplicar “listas de lavandería”, practicando todas las pruebas posibles, sino que hay que seleccionar en función del diagnóstico de sospecha. En las mujeres con una puntuación de hirsutismo por encima de lo normal, se sugiere solicitar:
- Analítica: testosterona total y, si esta es normal, pero se sospecha hiperandrogenismo, también testosterona libre a primera hora de la mañana(1). Es importante utilizar ensayos validados de alta calidad, tales como cromatografía líquida-espectrometría de masas e inmunoensayos de extracción y cromatografía(5), DHEAS, Androstendiona, FSL, LH, cociente LH/FSH (que, si es >2,5 es sugestivo de SOP), Prolactina, 17-hidroxiprogesterona (basal y tras estímulo con ACTH si la basal ofrece dudas), glucosa, insulina y cortisol libre urinario. Para excluir raras formas de HSCNCHSC, puede ser conveniente determinar, además de 17-hidroxiprogesterona y DHEAS, 17-hidroxipregnenolona, DHEA, 11-desoxicortisol, metabolitos urinarios de los corticoides y genotipo (CYP21A2)(1). Y para completar la visión de las posibles complicaciones metabólicas: perfil lipídico (dislipemia) y transaminasas (esteatosis hepática)(10).
- Radiología: ecografía ginecológica (preferentemente transvaginal), aunque algunos tumores ováricos secretores de andrógenos son demasiado pequeños para ser detectados por este método. Otras pruebas como TAC, RM o PET solo se solicitarán en caso de sospecha de tumores.
Enfoque terapéutico
Una dieta orientada a perder peso con bajo índice glucémico, con práctica de ejercicio físico, consiguen que las pacientes adelgacen, mejora la sensibilidad a la insulina y el síndrome metabólico asociado al SOP, y también la regularidad de los ciclos
El tratamiento del hirsutismo depende, solo en parte, de su etiología, y es común a la mayoría de los casos.
Puesto que la etiología más frecuente en la adolescencia es el SOP, comenzaremos comentando el tratamiento en esta patología. Teniendo en cuenta el origen multifactorial, las manifestaciones clínicas diversas y los procesos que pueden ir añadiéndose a lo largo del tiempo, el tratamiento del SOP contempla distintas opciones. No obstante, la mayoría van dirigidas a conseguir embarazos, por lo que quedan fuera de los objetivos de esta discusión. En cualquier caso, es imprescindible introducir modificaciones del estilo de vida. Una dieta orientada a perder peso cuando sea preciso, con bajo índice glucémico y pobre en grasas saturadas, junto con la práctica de ejercicio físico, consiguen que las pacientes adelgacen, mejora la sensibilidad a la insulina y el síndrome metabólico asociado al SOP, y también la regularidad de los ciclos(5,8).
Ningún tratamiento farmacológico ha sido aprobado por la FDA/EMA para su uso en adolescentes con SOP(6). No obstante, suelen prescribirse algunos fármacos.
El hirsutismo puede tratarse mediante la combinación de actuaciones con distintas dianas
El hirsutismo puede tratarse mediante la combinación de actuaciones con distintas dianas:
- Reducir la producción de andrógenos tomando anticonceptivos orales (ACO).
Son preferibles los ACO que contienen etinil-estradiol con progestágenos, ya que los nuevos ACO con 17-β-estradiol o valerato de estradiol, contienen una dosis de estrógenos que es improbable que supriman los andrógenos ováricos. Por otra parte, los ACO que solo tienen progestágenos, son ineficaces para tratar el hirsutismo. En aquellas mujeres con mayor riesgo de tromboembolismo venoso (por ejemplo, las que tienen >39 años), se recomienda iniciar tratamiento con un ACO que contenga 20 μg de etinil-estradiol y un progestágeno de bajo riesgo, como el norgestimato(1). En nuestro Servicio, solemos utilizar etinil-estradiol con drospirenona o acetato de ciproterona.
- Inhibir la acción periférica de los andrógenos, o inhibir la 5-α-reductasa que convierte la testosterona en dihidrotestosterona (DHT).
Disponemos de: a) Espironolactona, que bloquea el receptor de los andrógenos. La dosis oscila entre 50 y 200 mg/día; b) Ciproterona, que compite con la DHT a nivel del receptor, e inhibe la 5-α-reductasa. Puede usarse combinada con ACO, a dosis de 2 mg/día, o sola a dosis de 50-100 mg/día; c) Flutamida: también bloquea el receptor de los andrógenos, pero es hepatotóxica y no se recomienda, y d) Finasteride: inhibe la 5-α-reductasa. La dosis es de 1 a 5 mg/día.
Los antiandrógenos pueden añadirse a los 6 meses de tratamiento con ACO si el beneficio observado no es el esperado. En general, se recomienda esperar 6 meses antes de adoptar cualquier modificación terapéutica(1).
- Medidas cosméticas complementarias. En sentido estricto, convendría diferenciar la depilación (que quita el pelo por encima de la piel) de la epilación (que extrae el pelo por encima del bulbo. Para la depilación, habitualmente se usa el afeitado o agentes químicos. Para la epilación, las pinzas o la cera. Otra alternativa es la decoloración para casos más leves o localizados. Para la erradicación del vello, disponemos de la fotodepilación y la electrolisis. En mujeres de pelo castaño y en las morenas, se sugiere la fotodepilación. Y para las que tiene el pelo rubio, la electrolisis(1). En el caso de adolescentes con SOP, se recomienda fotodepilación con láser diodo o alejandrita más eflornitina tópica facial para ≥16 años(6).
- Los agonistas de GnRH de larga duración puede ser una alternativa a los ACO, pero solo se recomiendan en mujeres con hipertricosis que no han respondido a ACO más antiandrógenos(1).
- Sensibilizadores a la insulina: la metformina, que es un fármaco antihiperglucémico, reduce la concentración de insulina circulante con lo que reduce la producción de andrógenos. Suele emplearse en el tratamiento del SOP cuando se detecta resistencia a la insulina, como en el caso que nos ocupa. Suele mejorar la regularidad de los ciclos y la fertilidad, pero no el hirsutismo. La pioglitazona puede utilizarse como alternativa o complemento a la metformina(6).
El hirsutismo idiopático responde a los antiandrógenos o a los inhibidores de la 5-α- reductasa, aunque, dado su potencial efecto teratógeno, no se recomienda su uso en monoterapia. Por ello, se aconseja añadir ACO, que, además, contribuyen a suprimir la secreción de andrógenos ováricos, aunque, en este sentido, su beneficio es limitado. Como terapia no farmacológica, la depilación con láser ayuda a eliminar el vello no deseado(7).
En las distintas presentaciones de HSCNC, en las que los niveles de cortisol endógeno permanecen normales, y los valores del resto de metabolitos están solo ligeramente elevados, el tratamiento con corticoides (hidrocortisona), para reducir los niveles elevados de CRH y de ACTH, puede generar efectos adversos, por lo que no suele utilizarse. En su lugar, se establecen recomendaciones como las comentadas para las pacientes con SOP: dieta, ejercicio físico, medidas cosméticas y ACO más antiandrógenos a dosis bajas, si es necesario(12).
En resumen, describimos el caso de una paciente adolescente que consulta por hirsutismo. Tras la anamnesis, exploración clínica y exploraciones complementarias, se llega al diagnóstico de SOP. Se discuten las dudas diagnósticas y terapéuticas del hirsutismo en general y del SOP en particular. Las principales controversias se centran en el diagnóstico del SOP, ya que se pretende evitar retrasos y/o diagnósticos erróneos, tanto falsos positivos como falsos negativos.
Tablas y figuras
Tabla I. Definición de la gradación del vello corporal en cada una de las 11 localizaciones según la descripción original de Ferriman y Gallwey(2)
|
ÁREA |
GRADO |
DEFINICIÓN |
|
Labio superior |
1 2 3 4 |
Pelos aislados en el margen externo Un pequeño bigote en el margen externo El bigote se extiende al centro Un bigote completo |
|
Mentón |
1 2 3 y 4 |
Algunos pelos dispersos Pequeñas concentraciones de vello El mentón lleno de vello, ligero o denso |
|
Pecho |
1 2 3 4 |
Vello periareolar Además, vello en línea media intermamaria Fusión de los 2 anteriores Todo el pecho cubierto |
|
Parte superior de la espalda |
1 2 3 y 4 |
Vello aislado y escaso Vello aislado, más abundante Toda la parte superior de la espalda cubierta, de vello ligero o denso |
|
Parte inferior de la espalda |
1 2 3 4 |
Un mechón de vello sacro Además, con alguna extensión lateral Tres cuartas partes cubiertas de vello Toda cubierta de vello |
|
Abdomen superior |
1 2 3 y 4 |
Pocos pelos en línea alba Más vello en línea alba Medio o totalmente cubierto de vello |
|
Abdomen inferior |
1 2 3 4 |
Pocos pelos en línea alba Mechón en línea alba Banda de vello en línea alba Crecimiento de vello en V invertida |
|
Brazo |
1 2 3 y 4 |
Vello escaso, ocupando no más de ¼ de la superficie Más que la anterior, pero todavía incompleto Vello completo, ligero o denso |
|
Antebrazo |
1,2,3 y 4 |
Toda la superficie dorsal cubierta de vello; 2 grados de vello ligero y 2 de denso |
|
Muslo |
1,2,3 y 4 |
Como para el brazo |
|
Pierna |
1,2,3 y 4 |
Como para el brazo |
Tabla II. Definición de ciclos menstruales irregulares en adolescentes de acuerdo con el tiempo post-menarquia(5)
|
Tiempo post-menarquia |
Definición de ciclos menstruales irregulares |
|
Menos de 1 año |
Los ciclos menstruales irregulares son normales |
|
De >1 año a <3 años |
<21 o >45 días |
|
>3 años |
<21 o >35 días, o bien <8 ciclos/año |
|
Más de 1 año post-menarquia |
>90 días para cualquier ciclo Amenorrea primaria a la edad de 15 años o >3 años post-telarquia |
Tabla III. Criterios para el diagnóstico de SOP en la adolescencia(6)
Bibliografía
- Martin KA, Anderson RR, Chang RJ, Ehrmann DA, Lobo RA, Murad MH, Pugeat MM, Rosenfield RL. Evaluation and Treatment of Hirsutism in Premenopausal Women: An Endocrine Society Clinical Practice Guideline. J Clin Endocrinol Metab. 2018;103(4):1233-57.
- Rosenfield RL. Definition, clinical features, and differential diagnosis of polycystic ovary syndrome in adolescents. In: Post TW, ed. UpToDate, Inc. Waltham, MA: UpToDate; 2020. http://www.uptodate.com.
- Ferriman D, Gallwey JD. Clinical assessment of body hair growth in women.J Clin Endocrinol Metab. 1961; 21:1440-7.
- Wierman ME. Hyperandrogenic Anovulation. Differential Diagnosis and Evaluation. Endocrinol Metab Clin N Am 50 (2021) 1–10. https://doi.org/10.1016/j.ecl.2020.12.003.
- Peña AS, Witchel SF, Hoeger KM, Oberfield SE, Vogiatzi MG, Misso M, et al. Adolescent polycystic ovary syndrome according to the international evidence-based guideline. BMC Med 2020 Mar 24;18(1):72. doi: 10.1186/s12916-020-01516-x.
- Ibáñez L, Oberfield SE, Witchel S, Auchus RJ, Chang RJ, Codner E, et al. An International Consortium Update: Pathophysiology, Diagnosis, and Treatment of Polycystic Ovarian Syndrome in Adolescence. Horm Res Paediatr. 2017;88(6):371-95. doi: 10.1159/000479371.
- Azziz R, Carmina E, Sawava ME. Idiopathic hirsutism. Endocr Rev. 2000;21(4):347-62.
- Nicolaides NC, Matheou A, Vlachou F, Neocleus V, Skordis N. Polycystic ovarian sindrome in adolescents: from diagnostic criteria to therapeutic management. Acta Biomed 2020; 91 (3): e2020085. doi:10.23750/abm.v91i3.10162.
- Ho JH, Abd Wahab AV, Fung YK, Khoo SSK. An adolescent girl with coexisting ovarian mature cystic teratoma and HAIR-AN syndrome, an extreme subtype of polycystic ovarian síndrome. Endocrinol Diabetes Metab Case Rep 2021; 20-0195. doi: 10.1530/EDM-20-0195.
- Trent M, Gordon CM. Diagnosis and Management of Polycystic Ovary Syndrome in Adolescents. Pediatrics 2020; 145: S210-8.
- F Fruzzetti F,Baldari F, Palla G, Fidecicchi T, Carmina E. Comparison of PCOS phenotypes in adolescent and young adult Mediterranean women with possible PCOS. J Endocrinol Invest 2020, Aug 24. doi: 10.1007/s40618-020-01394-3.
- Sumińska M, Bogusz-Górna K, Wegner D, Fichna M. Non-Classic Disorder of Adrenal Steroidogenesis and Clinical Dilemmas in 21-Hydroxylase Deficiency Combined with Backdoor Androgen Pathway. Mini-Review and Case Report. Int J Mol Sci. 2020; 21(13):4622. doi: 10.3390/ijms21134622.