Talla baja
M.T. Muñoz Calvo, J. Pozo Román. Servicio de Endocrinología Pediátrica del Hospital Infantil Universitario Niño Jesús de Madrid. Profesores Asociados de Pediatría de la Universidad Autónoma de Madrid
Adolescere 2014;II (2): 28-44
Resumen
|
El crecimiento es el proceso fisiológico más característico de la infancia y la adolescencia. Aunque la talla adulta y la edad a la que ésta se alcanza están, en cada sujeto, determinadas genéticamente, el resultado final puede variar dependiendo de la compleja interacción a lo largo de todo el período de crecimiento de factores genéticos y ambientales. La talla baja supone un motivo de preocupación para los padres y es una causa muy frecuente de consulta en Pediatría y en Endocrinología Pediátrica; si bien, en la gran mayoría de los casos se tratará de variantes normales de talla baja que, salvo una adecuada información, no requerirán tratamiento. Se resumen los aspectos básicos que permitan al pediatra: 1) valorar si el crecimiento de un niño es normal o no; 2) conocer las causas que con más frecuencia pueden provocar su alteración; 3) saber cómo orientar el diagnóstico y cuándo remitir al especialista (a partir de la historia clínica, de la edad ósea y, en algunos casos, de un reducido número de pruebas complementarias fácilmente disponibles); y 4) conocer las opciones terapéuticas disponibles.
Palabras clave: Crecimiento, Talla baja, Malnutrición, Deficiencia de hormona de crecimiento.
|
Abstract
|
Growth is the most characteristic physiological process of childhood and adolescence. Although adult height and age at which this is achieved are genetically determined in each subject, the final result may differ depending on the complex interaction between genetic and environmental factors throughout the growth period. Short stature is a source of concern for parents and is a common reason for consultation to General Pediatrics and Pediatric Endocrinology; in most cases this will be a normal variant of short stature that will not require treatment but an adequate transmission of information. We have summarized the basic aspects that will help the pediatrician: 1) assess whether the growth of a child is normal or not; 2) know the causes that can most commonly affect it; 3) familiarise with diagnosis making and identifying when to refer to the specialist (based on the clinical history, bone age and, in some cases, a small number of additional tests); and 4) be aware of the available treatment options.
Keywords: Growth, Short stature, Malnutrition, Growth hormone deficiency.
|
Concepto
La talla y el ritmo madurativo de un sujeto concreto están determinados por una multitud de mecanismos genéticos y epigenéticos que interaccionan a lo largo de todo el proceso de crecimiento con factores ambientales intrínsecos y extrínsecos
En la práctica clínica (1), suelen utilizarse como criterios de hipocrecimiento:
• Las tallas que se sitúan por debajo de 2 desviaciones estándar (-2 DE) para la edad, el sexo y la etnia del individuo (aproximadamente el percentil 3/–1,88 DE).
• Las tallas que, aun estando en ± 2 DE para la población general, se sitúan mas de 2DE por debajo del carril de crecimiento correspondiente a su talla diana.
• Unas expectativas de talla adulta (predicción de talla adulta) mas de 2 DE por debajo de la talla diana.
• Una velocidad de crecimiento que se mantiene persistentemente disminuida.
Al igual que ocurre con la talla, no existe un consenso que establezca con claridad que es una velocidad de crecimiento (VC) disminuida, aunque suele considerarse como potencialmente patológica, una velocidad inferior a 1DE (aproximadamente percentil 25) para la edad y el sexo, pero mantenida durante más de 2-3 años.
Etiopatogenia y clasificación de los hipocrecimientos
Dentro de los hipocrecimientos, clásicamente, se han diferenciado dos grandes grupos etiopatogénicos: los hipocrecimientos normales o variantes normales de talla baja (VNTB) y los hipocrecimientos patológicos. En la actualidad (tabla I), tienden a clasificarse más como: hipocrecimientos de causa conocida e hipocrecimientos de causa desconocida o idiopáticos (TBI)
Hipocrecimientos de causa conocida
Representan alrededor del 20 % de los hipocrecimientos (2) y serían la consecuencia de trastornos patológicos que alterarían la capacidad de crecimiento intrínseca de los tejidos (osteocondrodisplasias, alteraciones del metabolismo óseo, retrasos de crecimiento intrauterino, cromosomopatías y síndromes dismórficos), sus mecanismos reguladores (hipocrecimientos de causa endocrinológica) o el ambiente interno (malnutrición y patología crónica en diferentes órganos y sistemas) y emocional del niño (hipocrecimiento psicosocial). Desde un punto de vista etiopatogénico y diagnóstico (tabla 1), pero también terapéutico, es útil, diferenciar, dentro de los hipocrecimientos el momento de su inicio (pre o postnatal) y si se conservan o no las proporciones corporales normales (armónico o disarmónico).
Los hipocrecimientos de inicio prenatal suelen ser el resultado de una agresión al ambiente fetal o de un defecto genético; por el contrario, los de inicio postnatal suelen responder, en general, a una agresión iniciada fuera del período de vida intrauterino. En lo que se refiere al mantenimiento o no de la armonía corporal, los hipocrecimientos disarmónicos, son siempre patológicos y pueden ser congénitos (osteocondrodisplasias) o, menos frecuentemente, adquiridos (radioterapia espinal); por el contrario, los armónicos pueden ser normales o patológicos.
Hipocrecimientos de inicio prenatal
Se suele considerar a un recién nacido (RN) como RNPEG (pequeño para edad gestacional) cuando su peso (PRN) y/o su longitud al nacimiento (LRN) se encuentran, al menos, 2 SDS por debajo de la media para su edad gestacional (≤ -2 SDS). En los países desarrollados, sólo el 4-7 % de los RN son RNPEG; sin embargo, es una de las causas más importantes de talla baja, ya que, el antecedente de RNPEG se encuentra en el 20% de los adultos con talla baja (3).
El patrón de crecimiento de los RNPEG suele ser bastante característico (3). El 80-90 % experimentan un crecimiento de recuperación, parcial o total, durante el primer o segundo año de vida y alcanzan una talla dentro de la normalidad (entre ± 2 SDS). El 10-20 % restante mantienen la talla baja después de los 2 años y en, al menos, un 50 % de estos, la talla final será baja. La edad ósea (EO) suele estar retrasada, pese a lo cual la pubertad se inicia habitualmente a una edad normal o incluso ligeramente adelantada, corrigiéndose rápidamente el retraso en la maduración ósea y alcanzando una talla final baja, que, en la mayoría de los casos, es similar en SDS a la talla prepuberal. Cuando el RN presenta una disminución combinada del PRN y de la LRN (RNPEG armónico) el riesgo de alcanzar una talla adulta baja es mayor que cuando sólo se afecta el PRN (RNPEG disarmónico)
Desde el punto de vista etiopatogénico, una tercera parte de los RNPEG se deberían a factores fetales (cromosomopatías, anomalías congénitas y síndromes dismórficos) y las otras dos terceras partes a factores maternos (malnutrición, infecciones, tóxicos…) y uterino-placentarios (malformaciones uterinas, arteria umbilical única…); no obstante, hasta en un 40 % de los casos no se identifica ninguna causa patológica.
Multitud de cuadros sindrómicos (Russell-Silver, Seckel, Cornelia de Lange, Noonan, Prader-Willi…), muchos de ellos de causa genética (mutaciones, deleciones, disomías uniparentales…), al igual que ocurre en la mayoría de las cromosomopatías, presentan, como una de sus principales manifestaciones clínicas, talla baja, con frecuencia, pero no siempre, de inicio prenatal. El hipocrecimiento se asocia frecuentemente, además de a rasgos dismórficos más o menos específicos y marcados, a malformaciones en diferentes órganos y a un grado variable de retraso mental; de ahí, la importancia de buscar sistemáticamente en la exploración de todo niño con talla baja, la presencia de rasgos sindrómicos que orienten hacia este tipo de diagnósticos.
Entre las cromosomopatías, merecen especial mención por su frecuencia: el síndrome de Down (trisomía 21; 1:600 RN vivos) y el síndrome de Turner (45, X0, y sus variantes; 1:2.500-3.000 RN vivas). Las características fenotípicas del síndrome de Down hacen que su diagnóstico se realice, habitualmente, en el periodo neonatal; por el contrario, el diagnóstico del síndrome de Turner suele hacerse más tardíamente. Sus rasgos síndrómicos característicos (implantación posterior del cabello baja y en forma de “M”, pterigium colli, acortamiento de metacarpianos, cúbito valgo, tórax en coraza…) pueden ser poco manifiestos o pasar desapercibidos, aunque el fracaso de crecimiento, sobre todo a partir de los 2-3 años (sólo un 16 % son RNPEG), es prácticamente constante; tanto es así, que: “en cualquier niña con talla baja de causa desconocida, aun en ausencia de cualquier rasgo sindrómico, es obligada la realización de un cariotipo”.
Osteocondrodisplasias
Representan anomalías primarias del hueso y del cartílago, de base genética y herencia variable, que, habitualmente, dan lugar a un talla baja disarmónica. Individualmente son entidades raras, pero colectivamente integran un grupo numeroso (2-5:10.000 RN) y, en función de sus características clínicas, radiológicas y forma de herencia, se distinguen más de 300 tipos diferentes (4). El hipocrecimiento y la desproporción entre miembros y tronco puede ser debida a un acortamiento preferentemente de los miembros (acondroplasia, hipocondroplasia, discondrosteosis de Leri-Weill, condrodisplasia metafisaria…), del tronco (mucopolisacaridosis, displasia espondiloepifisaria…) o de ambos (displasia metatrópica…), y puede o no estar presente en el momento del nacimiento.
Entre las osteocondrodisplasias que por su frecuencia, expresividad clínica, herencia dominante y patrón de crecimiento pueden confundirse con un hipocrecimiento armónico, y en especial con variantes normales de talla baja, se encontrarían la hipocondroplasia y la haploinsuficiencia del gen SHOX (short stature homeobox-containing gen) (5).
Hipocondroplasia. Ha sido descrita como una “forma leve” de acondroplasia; no obstante, aunque ambas enfermedades se heredan de forma autosómica dominante y se deben a mutaciones en el mismo gen (FGFR3), no se han descrito familias en las que coincidan ambas entidades. La mutación responsable más frecuente es Asn540Lys, pero sus bases moleculares son más heterogéneas que en el caso de la acondroplasia y otros genes podrían estar implicados. Desde el punto de vista clínico, no presentan el aspecto facial característico de la acondroplasia, el hipocrecimiento y la rizomelia son menos marcados y el incurvamiento de las piernas y el genu varum son frecuentes. Como en la acondroplasia, es característica la reducción progresiva de la distancia interpeduncular lumbar, de L1 a L5, y las anomalías en la pelvis. La talla adulta se sitúa alrededor de 132-150 cm, pero el hipocrecimiento puede no ser manifiesto hasta los dos años y confundirse, dados los antecedentes familiares, con una forma extrema de talla baja familiar.
Haploinsuficiencia del gen SHOX. El gen SHOX está localizado en la región PAR1 (región pseudoautosómica 1) en el extremo distal de Xp e Yp. Las mutaciones o deleciones en homocigosis o heterocigosis compuesta del gen SHOX (6) son excepcionales y serían responsables de una forma severa de osteocondrodisplasia, la llamada displasia mesomélica de Langer (deficit medio de talla de -6,2 SDS con aplasia de cúbito y peroné entre otras alteraciones). Por el contrario, las mutaciones o deleciones en heterocigosis (heredadas con caracter pseudoautosómico dominante) en SHOX/PAR1, aunque su incidencia no está plenamente establecida, parecen ser frecuentes (1:1.000-2.000) y serían responsables de la mayoría de los casos de discondrosteosis de Léri-Weill (60-80 %), así como de alrededor del 2-5 % de las tallas bajas aparentemente armónicas, consideradas a priori como talla baja idiopática (6). También, algunas de las manifestaciones clínicas del síndrome de Turner sería atribuibles a la haploinsuficiencia del SHOX.
Las manifestaciones clínicas más características son: hipocrecimiento mesomélico (acortamiento de antebrazos y parte inferior de las piernas), cubitus valgo, deformidad de Madelung (acortamiento e incurvación del radio con subluxación dorsal del extremo distal del cúbito, triangularización de los huesos del carpo y fusión prematura de las epífisis), acortamiento de metacarpianos y metatarsianos, paladar ojival, desarrollo anormal de las orejas, micrognatia y cuello corto. Estas manifestaciones clínicas son más marcadas en mujeres y después de la pubertad, pero, en cualquier caso, muestran una marcada variabilidad fenotípica, incluso entre los miembros de una misma familia con idéntica alteración molecular (falta de correlación genotipo-fenotipo); de hecho, el fenotipo clínico es un continuum que abarca desde formas muy severas de talla baja desproporcionada a formas muy leves de talla baja o normal, armónica o disarmónica, con o sin otras anomalías clínicas y radiológicas. Así, en lo que se refiere a la talla adulta, ésta es de, aproximadamente, 145 cm en mujeres y 155 en varones; si bien, alrededor del 50 % de los pacientes muestran una talla en los límites de la normalidad. Al comparar con los hermanos no afectados, la pérdida de talla supone, de media, unos 14,4 cm (2,4 SDS) en mujeres y unos 5,3 cm (0,8 SDS) en varones.
Malnutrición
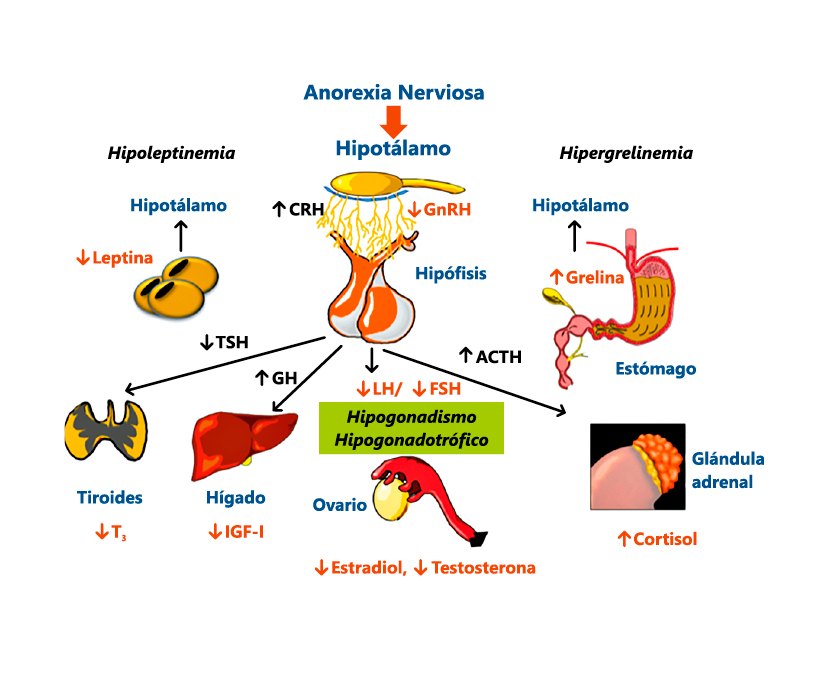
En los países desarrollados, la escasez de alimentos es un situación excepcional y los hipocrecimientos de causa nutricional suelen ser secundarios a: patologías crónicas, dietas inadecuadas en su cantidad (ejercicio excesivo) o composición (vegetarianas estrictas, macrobióticas…) o trastornos más o menos severos de la conducta alimentaria (anorexia nerviosa, síndrome del miedo a la obesidad, fallo de medro…). En cualquier caso, el resultado final de todas estas situaciones es un aporte insuficiente de macro (malnutrición calórico-proteica) o de micronutrientes (minerales y vitaminas).
En la malnutrición calórico-proteica, una pérdida o inadecuada ganancia ponderal suele acompañar o preceder a la alteración del crecimiento en uno o dos años; si bien, no siempre es así, y el fracaso de crecimiento, acompañado de retraso de la maduración ósea y de la pubertad, puede ser el mecanismo de adaptación a la disminución de nutrientes, sin que se altere la relación peso/talla u otros marcadores clínicos/bioquímicos de malnutrición (7). En este proceso adaptativo, todo el sistema hormonal esta implicado, pero son de especial importancia, las alteraciones en el eje GH-IGFs (resistencia a la GH, con niveles séricos normales o elevados de GH y disminuidos de IGF-I y de IGFBP-3).
En lo referente a los déficits aislados de micronutrientes, se ha demostrado que, además de las deficiencias de calcio y fósforo, algunos oligoelementos, como: iodo, hierro, cobre, cromo y zinc, son capaces de provocar cuadros de retraso de crecimiento en humanos. En los déficits vitamínicos aislados, la alteración del crecimiento no suele ser una manifestación clínica precoz, con excepción hecha de la vitamina D, que al igual que el calcio y el fósforo, está directamente implicada en la mineralización y crecimiento del hueso.
Infecciones e infestaciones recurrentes
Son características de los países subdesarrollados, donde los procesos infecciosos y parasitarios, especialmente gastrointestinales, actúan de manera sinérgica con la malnutrición en la génesis del fracaso de crecimiento. En los países desarrollados, las infecciones recurrentes son poco frecuentes, pero, cuando alteran el crecimiento, suelen reflejar la existencia de malformaciones anatómicas (renales, pulmonares…) o inmunodeficiencias subyacentes (SIDA…) y contribuir al fracaso de crecimiento asociado a otras patologías crónicas. La malnutrición parece ser el principal mecanismo fisiopatológico implicado en estas formas de hipocrecimiento; ya que, la alimentación suplementaria durante los períodos de infección parece evitar o, al menos, disminuir sus repercusiones negativas sobre el crecimiento.
Enfermedades crónicas
El fracaso en el crecimiento y la talla baja consiguiente son hallazgos habituales en los niños que padecen enfermedades crónicas; de hecho, prácticamente, cualquiera de ellas puede producirlo si es lo suficientemente intensa y duradera (tabla 1). El porcentaje de hipocrecimientos secundarios a enfermedades crónicas resulta difícil de establecer, pero se calcula que supone alrededor de un 10-15 %; no obstante, es probable que este porcentaje esté infravalorado y, además, que se incremente en los próximos años como consecuencia de la mayor supervivencia en muchas de las enfermedades crónicas.
Los factores etiopatogénicos implicados en el fracaso del crecimiento asociado a las enfermedades crónicas son múltiples y varían dependiendo de la enfermedad de base, pero suelen estar en relación con: malnutrición, alteraciones metabólicas, efectos secundarios de la terapia, infecciones sobreañadidas y, posiblemente también, con los trastornos psicológicos que acompañan al padecimiento de una enfermedad crónica. Dentro de ellos, la malnutrición, a la que se puede llegar por múltiples mecanismos (disminución de aportes o incremento de pérdidas o demandas), es uno de los factores más importantes y constantes.
En lo que se refiere a las manifestaciones clínicas, las específicas de la enfermedad de base serán, en la mayoría de los casos, las predominantes en el cuadro clínico y el fracaso del crecimiento será sólo un síntoma más. No obstante, en determinadas patologías, como: el hipocrecimiento nutricional, la enfermedad celíaca, la enfermedad inflamatoria intestinal o la acidosis tubular renal, entre otras, el hipocrecimiento puede ser, durante años, el único o el principal síntoma de la enfermedad subyacente.
El patrón de crecimiento suele ser similar en todas ellas. La aparición de la enfermedad va a determinar un enlentecimiento más o menos marcado del ritmo de crecimiento que suele acompañarse de un retraso simultáneo de la maduración ósea y del desarrollo puberal. En caso de curación o mejoría significativa, se producirá una “crecimiento de recuperación” que puede permitir recuperar, total o parcialmente, la talla perdida. La medida en que el hipocrecimiento puede ser compensado depende de diferentes factores: edad de inicio, gravedad y duración del fracaso en el crecimiento, etiología y patogénesis de la enfermedad y, también, de factores individuales propios de cada sujeto. En general: “cuanto más precoz, grave y prolongada sea la enfermedad que ocasiona la alteración del crecimiento, menos posibilidades hay de que pueda recuperarse completamente”.
Enfermedades endocrinológicas
Deficiencia de hormona de crecimiento (GH). Su incidencia oscila entre 1:3.500-1:10.000 RN vivos. El déficit de GH puede presentarse de forma aislada o asociado a otras deficiencias de hormonas hipofisarias (hipopituitarismos) y puede ser congénito (alteraciones genéticas, malformaciones de línea media…) o adquirido (tumores, traumatismos, histiocitosis, infecciones, radioterapia…). En la mayoría de los casos, el déficit es idiopático y sólo en aproximadamente un 20 % de los casos es posible identificar una causa orgánica responsable. Entre las formas idiopáticas, es frecuente el hallazgo en la RM craneal de determinadas anomalías morfológicas, como son: hipoplasia hipofisaria, tallo hipofisario ausente o muy reducido y neurohipófisis ectópica. Esta asociación, conocida como “síndrome de sección del tallo hipofisario”, aunque de etiopatogenia no aclarada, constituye un dato diagnóstico relevante y conlleva un mayor riesgo de desarrollar en el tiempo otras deficiencias hipofisarias. Se supone que un 5-30 % de las formas idiopáticas tendrían una base genética, bien por mutaciones en el gen de GH (deficiencia o GH biológicamente inactiva) o de GHRH (hormona hipotalámica liberadora de GH) que condicionarían una deficiencia aislada de GH, o bien por mutaciones en genes que codifican para factores de transcripción implicados en el desarrollo de la hipófisis (HESX1, LHX3, LHX4, POUIFI, PROPI…) que condicionarían deficiencias hipofisarias múltiples (8).
La manifestación clínica más característica de la deficiencia de GH es el fracaso de crecimiento, que se acompaña de una marcada disminución de la VC y de retraso de la EO. La secreción espontánea de GH y/o la respuesta de GH a los diferentes test de estimulación están disminuidas, al igual que los niveles séricos de IGF-I e IGFBP-3. En las formas congénitas o graves de inicio muy precoz, el hipocrecimiento puede estar presente ya en los primeros meses de vida y acompañarse de un fenotipo característico: cara de “muñeca”, voz aguda, incremento periabdominal de la grasa, manos y pies pequeños, disminución de la masa muscular… Clásicamente, el déficit congénito de GH se ha asociado a complicaciones perinatales (sufrimiento fetal, presentación podálica, fórceps, hipoglucemia e hiperbilirrubinemia conjugada), así como a un pene pequeño en los varones (frecuente deficiencia asociada de gonadotropinas). En las formas adquiridas de inicio más tardío, el hipocrecimiento puede ser la única manifestación clínica.
Insensibilidad a la GH. Se definiría como la ausencia de una apropiada respuesta metabólica y de crecimiento a la GH endógena o a la GH administrada a dosis fisiológica de sustitución. La insensibilidad adquirida a la GH es una situación clínica relativamente frecuente; ya que, se asocia a patologías crónicas y especialmente a la malnutrición calórico-proteica. Por el contrario, la formas de insensibilidad congénita a la GH, por anomalías en el receptor de GH (RGH), salvo en determinadas poblaciones con alto grado de consanguinidad, son extraordinariamente infrecuentes. En la mayoría de los casos, se trataría de mutaciones en homocigosis o heterocigosis compuesta, de herencia autosómica recesiva, que darían lugar a una insensibilidad total a la acción de la GH. El hipocrecimiento en estos casos es severo y el fenotipo característico (síndrome de Laron), similar en muchos aspectos al de la deficiencia completa de GH. Los niveles séricos de GH son normales o elevados y disminuidos los de IGF-I e IGFBP-3. Se han descrito, también, formas congénitas de insensibilidad parcial a la GH, debidas a mutaciones en heterocigosis del RGH, que darían lugar a formas de hipocrecimiento menos severas. Así mismo, se han descrito recientemente situaciones excepcionales de insensibilidad total o parcial a la GH por alteración de los mecanismos post-receptor encargados de la transmisión del mensaje de GH (mutaciones en STAT-5b), así como por deficiencia de la subunidad ácido lábil (mutaciones en IGFALS), deficiencia de IGF-I (mutaciones en el gen del receptor de IGF-I) , todas ellas de muy escasa incidencia.
Hipotiroidismo. Representa, en la actualidad, menos de un 1 % del total de hipocrecimientos, gracias a la aplicación generalizada del despistaje neonatal, al mejor control en las áreas de bocio endémico y a la mejoría, en general, en el diagnóstico y tratamiento de los hipotiroidismos adquiridos (tiroiditis linfocitaria crónica, lo más frecuente). El hipocrecimiento y el retraso en la EO y en el inicio de la pubertad son hallazgos habituales en las situaciones de hipotiroidismo prolongado.
Hipercortisolismo. La alteración del crecimiento en situaciones de hipercortisolismo crónico (síndrome de Cushing) es un fenómeno prácticamente constante y suele ser, junto con la obesidad, la manifestación clínica más precoz. El síndrome de Cushing es debido en la mayoría de los casos a una hipersecreción de ACTH (enfermedad de Cushing), a un tumor suprarrenal o a la administración exógena y mantenida de glucocorticoides.
Exceso de esteroides sexuales. El exceso de esteroides sexuales durante la fase prepuberal determina una aceleración anormal de la VC y de la EO y, por tanto, un hipercrecimiento transitorio; sin embargo, la estimulación desproporcionada de la maduración epifisaria conduce simultáneamente a un cierre precoz de los cartílagos de crecimiento y a una talla final baja. Estos efectos son el resultado de una acción directa de los esteroides sexuales sobre la placa de crecimiento, pero también de un incremento de la secreción de GH. El incremento de esteroides sexuales durante la infancia puede obedecer a numerosas causas y puede resultar de una activación precoz, idiopática o de causa orgánica, del eje hipotálamo-hipófiso-gonadal (pubertad precoz verdadera) o puede producirse independientemente de las gonadotropinas hipofisarias (pseudopubertad precoz), como sería el caso, entre otros, de la hiperplasia suprarrenal congénita.
Pseudohipoparatiroidismo (PHP). Representan un grupo heterogéneo de enfermedades, extremadamente infrecuentes, que se caracterizan por una resistencia en los órganos diana (hueso y riñón) a la acción de la paratohormona (PTH). Desde el punto de vista bioquímico, se caracterizan por hipocalcemia, hiperfosfatemia y niveles supranormales de PTH que no se acompañan de incremento de 1-25 (OH)2 vitamina D ni de hiperfosfaturia. Muchos de estos pacientes presentan, además, un fenotipo peculiar (talla baja, obesidad, cara redonda, retraso mental leve-moderado) y anormalidades óseas (osteodistrofia hereditaria de Albright).
Hipocrecimiento psicosocial
Se define como: “un síndrome de talla baja y/o retraso puberal que se produce en niños y adolescentes en situaciones de hostigamiento psicológico o deprivación afectiva y para el que no se encuentra otra explicación” Los mecanismos fisiopatológicos que median esta forma de hipocrecimiento son desconocidos, aunque en algunos casos se han implicado alteraciones en el eje de la GH-IGFs. Su diagnóstico es difícil y requiere un alto índice de sospecha.
Hipocrecimientos de causa desconocida (talla baja idiopática)
La definición de talla baja idiopática es una condición en la que la talla de un individuo se encuentra más de 2 SDS por debajo de media para su edad, sexo y grupo de población, sin evidencia de anomalías sistémicas, endocrinas, nutricionales o cromosómicas. Esta definición, incluye a los niños con variantes normales de talla baja (VNTB) y excluye, especificamente, niños con: peso y/o talla baja para su EG, fenotipo dismórfico o disarmónico (displasia ósea, síndrome de Turner, entre otros), trastorno psiquiátrico o emocional grave u otras causas claramente identificables de talla baja (por ejemplo: enfermedad celíaca, enfermedad inflamatoria intestinal, malnutrición, deficiencia o insensibilidad a la GH, hipotiroidismo, síndrome de Cushing, etc.).
Las VNTB son la causa más frecuente de talla baja en la infancia. Se trata de hipocrecimientos armónicos de inicio postnatal que resultarían de la variabilidad normal tanto de la talla como del ritmo madurativo que existe en la especie humana (9). Nuestro desconocimiento de los mecanismos fisiológicos que subyacen al control genético del crecimiento y del ritmo madurativo, así como nuestra incapacidad para predecir con fiabilidad la talla adulta de un niño, han condicionado su inclusión en el grupo de TBI. Dentro de las VNTB se incluyen: la talla baja familiar (TBF), el retraso constitucional del crecimiento y de la pubertad (RCCP) y la frecuente asociación de ambos patrones de crecimiento (tabla 2). El término de TBF hace referencia a un grupo de individuos con talla baja, por otro lado sanos, que maduran a un ritmo normal y cuyos familiares más próximos son de talla baja. Por su parte, los pacientes con RCCP serían sujetos sanos que, como consecuencia de un ritmo de maduración más lento que la media de la población (alrededor del 60 % tienen antecedentes familiares de maduración tardía), presentan durante la infancia una talla baja, inadecuada para su contexto familiar, retraso de la maduración ósea (2-3 años), inician la pubertad tardíamente y alcanzan la talla adulta a una edad superior a la media de la población. En ambas situaciones, la talla final es acorde con el contexto familiar, aunque este resultado no es exclusivo de las variantes normales; dado que, existen hipocrecimientos patológicos hereditarios susceptibles de condicionar una talla final acorde con el contexto familiar.
Se estima que, aproximadamente, el 80 % de los niños que consultan por talla baja podrían ser diagnosticados de TBI. La inmensa mayoría de estos niños (80-85 %) corresponderían a VNTB y un pequeño porcentaje (15-20 %) a patologías en las que, por desconocimiento o dificultad diagnóstica, no se llega a alcanzar un diagnóstico, como sería el caso de: hipocrecimientos nutricionales, hipocrecimientos psicosociales, alteraciones infrecuentes o menores en el eje GH-IGFs, así como osteocondrodisplasias, cuadros sindrómicos o alteraciones genéticas (microdeleciones, duplicaciones, disomías uniparentales…) de escasa expresividad clinica, entre otras posibles causas.
Orientación diagnóstica y pruebas complementarias
La evaluación inicial (tabla 3) de todo paciente que consulta por hipocrecimiento incluirá, como en cualquier otra patología, una historia clínica exhaustiva y un examen clínico completo, al que debe añadirse una valoración auxológica básica, la determinación de la maduración ósea (edad ósea) y, si es posible, el análisis del patrón de crecimiento a partir de los datos aportados por los padres o acumulados en la historia del niño (10). Los datos obtenidos de esta evaluación inicial nos permitirán, al menos, determinar si se trata de un hipocrecimiento armónico o disarmónico y si es de inicio prenatal o postnatal, y así orientar el diagnóstico y las pruebas complementarias (figura 1).
Si el hipocrecimiento es disarmónico, prenatal o postnatal
Si la talla baja se asocia con unas proporciones corporales anormales, debe remitirse al especialista y considerarse como una osteocondrodisplasia. El estudio radiológico de todo el esqueleto es la prueba diagnóstica más importante, al permitir determinar qué partes del esqueleto están más afectadas y la búsqueda de signos específicos de determinadas osteocondrodisplasias. Si se sospecha una osteocondrodisplasia de base genética conocida (acondroplasia, hipocondroplasia, o haploinsuficiencia de SHOX, entre otras), pueden realizarse estudios moleculares que confirmen el diagnóstico.
Si el hipocrecimiento es armónico y de inicio prenatal
Si no existe constancia de patología materna o placentaria que justifique el inicio prenatal del hipocrecimiento, y especialmente si el niño presenta retraso mental o psicomotor, alguna malformación, un fenotipo peculiar o algún rasgo sindrómico, debe considerarse la posibilidad de que se trate de una cromosomopatía o de un síndrome dismórfico; por lo que, estaría indicada la realización de un cariotipo y la remisión al especialista. Existe un número considerable de cuadros síndrómicos en los que el hipocrecimiento, de inicio prenatal o postnatal, es una de sus principales características. Muchos de ellos tienen una base genética, pero la mayoría no muestran alteraciones en el cariotipo convencional y su reconocimiento requiere de una gran experiencia por parte del médico que lo observa.
Si se ha diagnosticado un síndrome de base genética conocida y la metodología está accesible (síndromes de Prader-Willi, Noonan, Cornelia de Lange…), es recomendable confirmar molecularmente el diagnóstico clínico. En caso de que las características clínicas del paciente no orienten hacia un diagnóstico concreto, se puede considerar, la posibilidad de realizar lo que se conoce como “estudios de asociación a lo ancho del genoma” o GWAS (genoma-wide association studies). Dentro de estos estudios, los más utilizados en la detección de estas patologías son: los arrays-SNP (SNP: single nucleotide polymorphism), que permiten detectar cientos o miles de SNPs (variaciones de una sola base en el ADN), que son el tipo de polimorfismo más frecuente; y los arrays-CGH (CGH: hibridación genómica comparada) que permiten detectar variaciones en la dosis o número de copias del genoma (microdeleciones, microduplicaciones o disomías uniparentales).
Si el hipocrecimiento es armónico y de inicio postnatal
Si la talla no está severamente afectada, entre -2 y -3 SDS, existen antecedentes familiares de TBF o de RCDP y no existen datos sugerentes de hipocrecimiento patológico (figura 1), en la mayoría de los casos se tratará de una VNTB. Estos hallazgos, junto con un patrón de crecimiento característico y una predicción de talla adulta acorde con la talla familiar, permitirán establecer un diagnóstico provisional de VNTB. La constatación, a los 6 y 12 meses, de la existencia de una VC normal, prácticamente confirmará el diagnóstico. Si, por el contrario, la VC es patológica, se deberá reconsiderar el diagnóstico y valorar la realización de estudios complementarios o la remisión del paciente al especialista.
Si la afectación de la talla es severa, por debajo de -3 SDS, o existen otros datos sugerentes de patología (tabla 3), deberán realizarse pruebas complementarias. En muchos de los casos, la valoración inicial nos permitirá establecer un diagnóstico de sospecha y orientar estas pruebas hacia una patología específica (nutricional, gastrointestinal, respiratoria…). Si no existen datos sugerentes de patología específica, será necesario practicar, junto con un seguimiento estrecho de la evolución clínica y auxológica del paciente, una serie de pruebas de laboratorio que permitan descartar, aquellas enfermedades en las que el hipocrecimiento pueda ser la manifestación inicial o que, por su escasa expresividad clínica, puedan pasar desapercibidas.
Tratamiento
La talla baja no es una enfermedad, sino un síntoma. Por ello: en muchos casos, el tratamiento, salvo una adecuada información al niño y a sus padres, no será necesario; en otros, consistirá únicamente en el tratamiento de la enfermedad responsable; y, por último, en un pequeño número de pacientes, puede ser necesaria la utilización de tratamientos específicos para estimular o mejorar el crecimiento.
En la práctica, disponemos de un número limitado de terapias capaces de influir beneficiosamente sobre el crecimiento, como son: la GH y el IGF-1 recombinantes, el tratamiento con fármacos moduladores de la pubertad y el alargamiento óseo.
Hormona de crecimiento
La GH estimula el crecimiento longitudinal de los huesos largos de manera prácticamente dosis-dependiente y es el tratamiento específico de los déficit de GH; no obstante, se ha utilizado experimentalmente en la mayoría de las formas hipocrecimiento (TBI, displasias esqueléticas, síndromes dismórficos…). En la actualidad, las indicaciones aceptadas para el tratamiento con GH en España (11), además de la deficiencia de GH (niños y adultos), son: el síndrome de Turner, el hipocrecimiento asociado a insuficiencia renal crónica, la falta de recuperación de la talla en los RNPEG, el síndrome de Prader Willi y la haploinsuficiencia del gen SHOX. La GH se administra por vía subcutánea, diaria, habitualmente antes de acostarse, en una dosis única de 0,025-0,035 mg/kg/día, en los pacientes deficitarios, y de 0,045-0,05 mg/kg/día, en el resto de situaciones no deficitarias.
Los riesgos conocidos del tratamiento con GH en los pacientes deficitarios son escasos, las más frecuentes: epifisiolisis de la cabeza femoral y pseudotumor cerebri (hipertensión intracraneal benigna), con una frecuencia aproximada, en ambos casos, de 1:1000 niños tratados. A dosis más altas y mantenidas, puede haber disminución de la sensibilidad a la insulina y desarrollo de rasgos acromegaloides. En cualquier caso, la experiencia a largo plazo en pacientes no deficitarios y con dosis altas de GH es escasa y sus potenciales riesgos desconocidos. Esta incertidumbre debería hacer extremar la prudencia sobre su uso indiscriminado en patologías en las que sus hipotéticos beneficios no hayan sido suficientemente probados.
Factor de crecimiento semejante a la insulina (IGF-1)
El IGF-1 recombinante está disponible en España desde 2008. Estaría indicado en la deficiencia primaria de IGF-I por resistencia genética a la acción de la GH (anomalías en el receptor de GH o en sus vías de señalización intracelular) o bien por mutaciones en el gen de IGF-1 (12). La dosis recomendada es de 0,04-0,08 mg/kg/día (máximo: 0,12 mg/kg/día), repartida en dos dosis y administrada, cada 12 horas, por vía subcutánea, preferentemente antes de una comida para prevenir hipoglucemias.
La experiencia clínica en la utilización del IGF-I recombinante es escasa. Los estudios a corto y medio plazo demuestran en ellos la eficacia del tratamiento, aunque sus resultados son menores que los obtenidos con la GH en los pacientes deficitarios. Los efectos secundarios más frecuentes que hasta ahora se han visto asociados al tratamiento con IGF-I son: hipoglucemias, aumento del tejido linfático (amígdalas, adenoides, bazo y timo), náuseas, vómitos, cefalea y papiledema (pseudotumor cerebri), prurito y aumento de transaminasas.
Moduladores de la pubertad
La utilización de fármacos moduladores de la pubertad en el tratamiento de la talla baja es relativamente reciente y sus efectos beneficiosos insuficientemente probados; por lo que, su indicación no ha sido aceptada y su utilización debería ser considerada todavía experimental. Los fármacos más utilizados han sido los análogos de GnRH (aGnRH) y más recientemente los inhibidores de 3ª generación de la aromatasa (IA: anastrozole y letrozole), la enzima que cataliza, en condiciones normales, el paso de andrógenos a estrógenos.
El objetivo de los aGnRH en el tratamiento de la talla baja sería frenar la producción de esteroides sexuales, alargando el periodo de crecimiento prepuberal. Los estudios disponibles indican que, administrados aisladamente en pacientes con talla baja y pubertad normal o adelantada, no son útiles para mejorar la talla adulta, y que asociados con GH conducirían, en el mejor de los casos, a un beneficio modesto en la talla adulta, cuando el tratamiento combinado se mantiene durante al menos 3 años.
En el caso de los IA, su objetivo sería enlentecer el cierre de las placas de crecimiento (mediado principalmente por los estrógenos) y prolongar el crecimiento lineal. Los estudios iniciales, en varones con RCCP y TBI, son muy prometedores y sugieren beneficios en la talla adulta de alrededor de 5 cm tras 1-2 años de tratamiento; no obstante, el escaso número de pacientes tratados y la limitada disponibilidad de datos a talla final aconseja limitar todavía su utilización a estudios controlados.
Alargamiento óseo
Se realiza habitualmente en tibias, fémures y húmeros. Su indicación más habitual, generalmente a partir de los 9-12 años, son las displasias óseas, especialmente aquellas con huesos sólidos y afectación preferente de extremidades, como la acondroplasia. En las tallas bajas no displásicas, la indicación de la elongación ósea es más controvertida y suele realizarse una vez finalizado el crecimiento, cuando otros tratamientos han fracasado en la consecución de una talla “aceptable” para el paciente.
Tablas y figuras
Tabla I. Clasificación etiopatogénica de los hipocrecimientos
|
Hipocrecimientos de etiopatogenia conocida
|
|
Disarmónicos
|
|
Congénitos: Osteocondrodisplasias (pueden ser de inicio pre o postnatal)
Adquiridos: Secundarios a malformaciones, radioterapia…
|
|
Armónicos de inicio prenatal (RNPEG)
|
|
• Debidos a factores fetales
— Defectos cromosómicos (Turner, Down, Prader-Willi…)
— Síndromes (Silver-Russell, Cornelia de Lange, Noonan…)
— Alteración de los mecanismos reguladores (insulina, IGFs…)
• Debidos a factores uterinos y placentarios
— Malformaciones uterinas o del cordón
— Implantación placentaria anómala
• Debidos a factores maternos
— Malnutrición
— Tóxicos (drogas, alcohol, tabaco…)
— Patología cardíaca y vascular
— Infecciones congénitas (TORCH)
|
|
Armónicos de inicio postnatal
|
|
• Malnutrición:
— Malnutrición calórico-proteica
— Déficit de micronutrientes (Fe, Zn, vit. D…)
• Infecciones/infestaciones crónicas y/o recurrentes
— Infestación por Giardia Lamblia
— Inmunodeficiencias (SIDA…)
• Enfermedades crónicas:
— Gastrointestinales (celiaquía, EII, FQ, intestino corto, enteropatía autoinmune…)
— Hepáticas (atresia de vías biliares, hepatitis crónicas, fracaso hepático, trasplante hepático…)
— Renales (glomerulares, intersticiales, tubulares)
— Cardíacas (especialmente las cardiopatías cianosantes)
— Pulmonares (FQ, asma, displasia broncopulmonar, Apnea obstructiva, secuestro pulmonar…)
— Metabólicas (DM mal controlada, EIM…)
— Hematológicas (anemia crónica severa, hemocromatosis)
— Neoplásicas (leucemias, linfomas, tumores del SNC, trasplante de médula ósea…)
— Sistema nervioso central (PCI, mielomeningocele, retraso mental…)
— Reumatológicas (artritis crónica juvenil, LES…)
• Enfermedades endocrinológicas:
— Déficit o insensibilidad a la GH/IGF-I
— Hipotiroidismo
— Hipercortisolismo
— Pubertad y pseudopubertad precoces
— Pseudohipoparatiroidismo
— Raquitismos hereditarios (hipocalcémicos e hipofostatémicos)
— Diabetes mellitus mal controlada
— Diabetes insípida no tratada
• Deprivación psicosocial
|
|
Hipocrecimientos de etiopatogenia desconocida (TALLA BAJA IDIOPÁTICA)
|
|
Variantes normales de talla baja:
— Talla baja Familiar (TBF)
— Retraso constitucional del crecimiento y de la pubertad (RCCP)
— Asociación de TBF y RCCP
Otras causas de diagnóstico no aclarado
|
|
*EII: enfermedad inflamatoria intestinal; FQ: fibrosis quística; DM: diabetes mellitus; EIM: errores innatos del metabolismo; PCI: parálisis cerebral infantil; LES: lupus eritematoso sistémico; GH: hormona de crecimiento; IGF: factor de crecimiento semejante a la insulina. RNPEG: recién nacidos pequeños para su edad gestacional. SNC: sistema nervioso central
|
Tabla II. Características clínicas de las variantes normales de talla baja
|
Características clínicas
|
TBF
|
RCCP
|
TBF+RCCP
|
|
• PRN y LRN
• Antecedentes familiares
• Inicio del hipocrecimiento
• Ritmo de maduración
• Ritmo de crecimiento lento
• Inicio de la pubertad
• Talla final
|
Normal
Talla baja
Postnatal
Normal
Entre 1-4 años
Normal
Baja
|
Normal
Maduración tardía
Postnatal
Lento
Entre 1-4 años
Peripuberal
Tardío
Normal
|
Normal
Talla baja
Maduración tardía
Postnatal
Lento
Entre 1-4 años
Peripuberal
Tardío
Baja
|
|
* TBF: talla baja familiar; RCCP: retraso constitucional del crecimiento y de la pubertad; TBF+RCCP: asociación de TBF y RCCP;
PRN: peso al nacimiento; LRN: longitud al nacimiento
|
Tabla III. Puntos de especial interés en la anamnesis y exploración de un niño que consulta por talla baja o hipocrecimiento
|
Historia familiar
|
|
• Componente familiar de talla:
— Talla de padres, hermanos u otros familiares próximos (árbol genealógico)
— Presencia de hipocrecimiento disarmónico en familiares
• Ritmo madurativo familiar:
— Pubertad adelantada o retrasada en padres, hermanos u otros familiares próximos
— Edad de la menarquia o estirón puberal en padres, hermanos u otros familiares próximos
• Consanguinidad: incrementa mucho el riesgo de trastornos genéticos recesivos
• País de origen, etnia y generación en el país: determina qué gráficas de crecimiento utilizar
• Enfermedades hereditarias
• Enfermedades endocrinológicas, autoinmunes…
• Rasgos fenotípicos anormales en familiares: riesgo de cuadros sindrómicos hereditarios
• Ambiente familiar (económico/cultural/social)
|
|
Historia personal
|
|
• Gestacional:
— Bienestar fetal y crecimiento intrauterino
— Ganancia ponderal y nutrición
— Inicio de movimientos fetales
— Patología gestacional (hemorragias, tóxicos…)
• Perinatal:
— Edad gestacional, PRN, LRN y PC
— Parto (instrumental, presentación, SFA…)
— Hipoglucemia/ictericia prolongada
• DPM, rendimiento escolar y alt. de conducta (retraso mental, síndromes, hipocrecimiento psicosocial…)
• Nutrición y ganancia ponderal (hipocrecimientos nutricionales y enfermedades crónicas)
• Enfermedades previas y tratamientos (hipocrecimientos asociados a patología crónica)
— Corticoterapia (dosis, continua/alterna, duración)
— Quimioterapia (medicamento, dosis, duración edad…)
— Radioterapia (edad, dosis, localización…)
— Fracturas (posibilidad de maltrato y de hipocrecimiento psicosocial)
• Anamnesis por aparatos: signos o síntomas que puedan sugerir patología crónica de escasa expresividad (hipotiroidismo, celiaquía…)
• Patrón de crecimiento y de ganancia ponderal: reconstruir curvas de peso y talla.
• Desarrollo puberal: Inicio y progresión de los caracteres sexuales secundarios. Menarquia
|
|
Exploración física completa
|
|
• Búsqueda de rasgos sindrómicos (Turner, Noonan, Silver-Rusell, Prader-Willi…)
• Búsqueda de signos de patología crónica inadvertida (malnutrición, hábito malabsortivo, obesidad y distribución de la grasa corporal, signos de negligencia o abuso, hipertensión arterial, tiroidomegalia, hepatoesplenomegalia…)
• Signos de negligencia, abuso o deprivación emocional
• Medición de parámetros antropométricos: valoración auxológica básica
— Talla, peso, perímetro cefálico e índice de masa corporal
— Velocidad de crecimiento
— Valorar armonía/disarmonía (braza, talla sentado, cociente segmento superior/segmento inferior…)
• Desarrollo puberal:
— Estadios de Tanner/volumen testicular
— Presencia de micropene y/o criptorquidia
|
|
Abreviaturas: PRN: peso al nacimiento; LRN: longitud al nacimiento; PC: perímetro cefálico al nacimiento; DPM: desarrollo psicomotor;
SFA: sufrimiento fetal agudo
|
Figura I. Algoritmo diagnóstico del hipocrecimiento
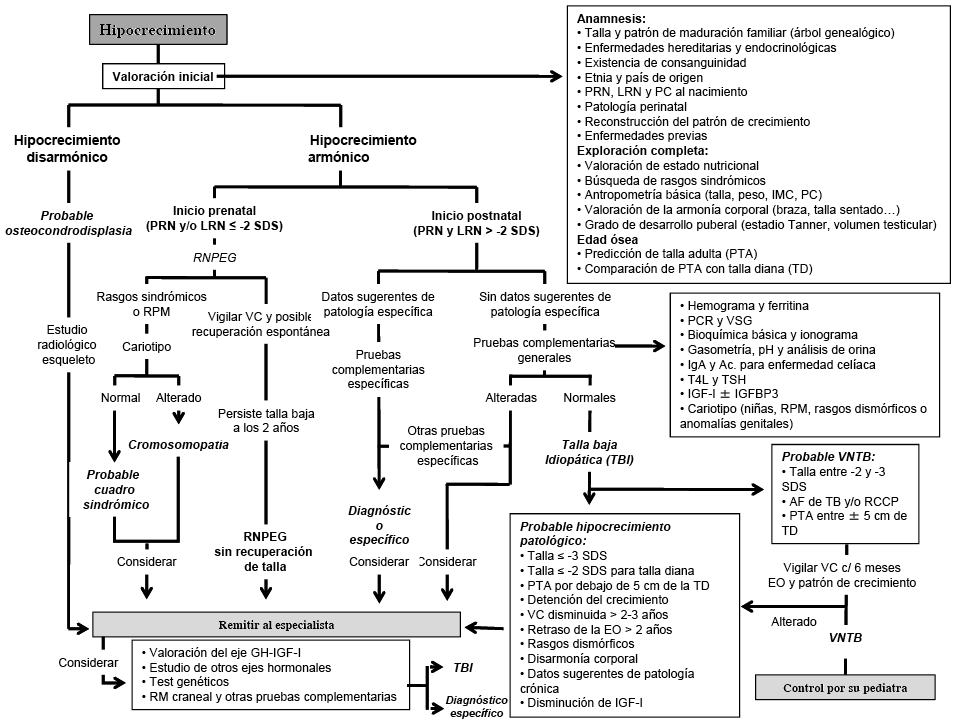
DE: desviación estándar; EO: edad ósea; GH: hormona de crecimiento; IGF-1: factor de crecimiento semejante a la insulina nº 1; IGFBP-3: proteína transportadora de IGFs nº 3; IMC: índice de masa corporal; LRN: longitud al nacimiento; PC: perímetro cefálico; PCR: proteína C reactiva; PRN: peso al nacimiento; RCCP: retraso constitucional del crecimiento y de la pubertad;RM: resonancia magnética, RNPEG: recién nacido pequeño para la edad gestacional; RPM: retraso psicomotor; T4L: tiroxina libre; TSH: hormona tirotropa; VC: velocidad de crecimiento; VNTB: variante normal de talla baja; VSG: velocidad de sedimentación globular.
Bibliografía
1. Ismail H, Ness K. Evaluation of short stature in children. Pediatr Ann. 2013 Nov;42:217-22.
2. Allen DB, Cuttler L. Clinical practice. Short stature in childhood–challenges and choices. N Engl J Med. 2013 Mar 28;368:1220-1228.
3. Clayton PE, Cianfarani S, Czernichow P, Johannsson G, Rapaport R, Rogol A. CONSENSUS STATEMENT: Management of the Child Born Small for Gestational Age through to Adulthood: A Consensus Statement of the International Societies of Pediatric Endocrinology and the Growth Hormone Research Society. J Clin Endocrinol Metab 2007; 92: 804–810.
4. Bueno-Sánchez M, Ramos-Fuentes FJ. Hipocrecimiento disarmónico: displasias esqueléticas. En: Cruz-Hernández M, ed. Tratado de Pediatría M. Cruz (10ª edición). Madrid: Ergon S.A., 2011; págs: 916-931.
5. Binder G. Short stature due to SHOX deficiency: genotype, phenotype, and therapy. Horm Res Paediatr 2011; 75: 81-89.
6. Rappold G, Blum WF, Shavrikova EP, Crowe BJ, et al. Genotypes and phenotypes in children with short stature: clinical indicators of SHOX haploinsufficiency. J Med Genet 2007; 44: 306-313.
7. Lifshitz F. Nutrition and growth. J Clin Res Ped Endo 2009; 1: 157-163.10)
8. Binder G. Growth hormone deficiency: new approaches to the diagnosis. Pediatr Endocrinol Rev. 2011;9 Suppl 1:535-7.
9. Cohen P, Rogol AD, Deal CL, Saenger P, Reiter EO, Ross JL, Chernausek SD, Savage MO, Wit JM; 2007 ISS Consensus Workshop participants.Consensus statement on the diagnosis and treatment of children with idiopathic short stature: a summary of the Growth Hormone Research Society, the Lawson Wilkins Pediatric Endocrine Society, and the European Society for Paediatric Endocrinology Workshop. J Clin Endocrinol Metab. 2008; 93: 4210-4217.
10. JM, Clayton PE, Rogol AD, Savage MO, Saenger PH, Cohen P. Idiopathic short stature: definition, epidemiology, and diagnostic evaluation. Growth Horm IGF Res 2008; 18: 89-110.
11. Collett-Solberg PF. Update in growth hormone therapy of children. J Clin Endocrinol Metab 2011; 96: 573-9.
12. Collett-Solberg PF, Misra M; Drug and Therapeutics Committee of the Lawson Wilkins Pediatric Endocrine Society. The role of recombinant human insulin-like growth factor-I in treating children with short stature. J Clin Endocrinol Metab 2008; 93: 10-18.