Transición de la edad pediátrica al cuidado adulto en adolescentes con cardiopatía congénita
Transición de la edad pediátrica al cuidado adulto en adolescentes con cardiopatía congénita
E.J. Balbacid Domingo.
Facultativo especialista. Instituto de Investigación Sanitaria del Hospital Universitario La Paz (idipaz) Área Cardiovascular. Grupo de Investigación en Cardiología Pediátrica. Madrid.
Fecha de recepción: 30-06-2024
Fecha de publicación: 31 de octubre 2024
Adolescere 2024;XII(3): 59-66
Resumen
|
La mayor parte de los niños con cardiopatías congénitas llegará a la vida adulta. El proceso de transición puede basarse en diversos modelos pero todos ellos colocan al paciente en el centro de la toma de decisiones y autocuidado. Las cuestiones cardiológicas y otros aspectos de salud no cardiológicos deben irse planteando desde etapas coincidentes con la adolescencia para finalmente producirse una trasferencia a las unidades de adultos sin problemas pendientes de resolver. Para ello se ha de dotar al sistema de salud y al paciente de los conocimientos y recursos necesarios para que este periodo vulnerable no termine en pérdidas del seguimiento. Palabras clave: Cardiopatía Congénita; Transición; Adolescencia. |
Abstract
|
Most children with congenital heart diseases will reach adulthood. The transition process can be based on various models, but they all place the patient at the center of decision-making and self-care. Cardiological issues and other non-cardiological health aspects should be addressed from the stage of adolescence to ultimately facilitate a transfer to adult units without unresolved issues. To achieve this, the healthcare system and the patient must be equipped with the necessary knowledge and resources to ensure that this vulnerable period does not result in loss of follow-up. Key words: Congenital Heart Disease; Transition; Adolescence. |
Introducción
Cada vez hay más adultos con cardiopatías congénitas (CC), lo que requiere una transición organizada desde los servicios de cardiología infantil a los de adultos
Cada vez existen más adultos con cardiopatías congénitas (CC). Dichos pacientes provienen de unidades y servicios de cardiología infantil en su mayor parte. Sin embargo, la propia evolución de su cardiopatía congénita y las cuestiones adquiridas hacen cada vez más difícil la perpetuación de sus cuidados en estos servicios infantiles y surge la necesidad de ordenar la transición a los servicios y hospitales de adultos. La mayor parte de los pacientes con una CC en nuestro medio, son adultos que en muchas ocasiones perdieron el seguimiento tras el fin de los cuidados en unidades pediátricas y se encuentran formando parte de una población general sin ser conscientes de que, incluso teniendo una CC simple, las complicaciones no son infrecuentes y la supervivencia se acorta a partir de la quinta o sexta década de la vida según la historia natural(1). Si bien la supervivencia de aquellos pacientes con una CC simple será parecida a la de un adulto sin CC con un adecuado seguimiento, la de los que tienen una CC de moderada o gran complejidad todavía no alcanzan la esperanza de vida de sus pares nacidos en el mismo momento en nuestro medio (Figura 1).
Figura 1: Supervivencia de las CC en función de su complejidad(1)
Fuente: (1) Bouma BJ, Sieswerda GT, Post MC, Ebels T, van Kimmenade R, de Winter RJ, et al. New developments in adult congenital heart disease. Neth Heart J 2020; 28:449.
Durante dicho proceso se han identificado varios factores que confluyen para hacer de este periodo clínico un tiempo vulnerable donde el paciente cambia de rol como sujeto pasivo a convertirse en principal responsable de decisiones por primera vez. Existe un gran desconocimiento de su propio proceso de enfermedad por parte de esta población de menores maduros y recién adultos que precisa de una nueva labor informativa y de educación para la salud. Se abre de repente una nueva era en la enfermedad de los pacientes cuya puerta siempre estuvo ahí como una meta pero que ahora se debe programar hasta el final de la vida desde un punto de vista científico y humanista al mismo tiempo.
La pérdida de seguimiento, los abandonos en el tratamiento, la falsa autoconsideración de curación, las frustraciones profesionales, la limitación funcional, el deseo genésico insatisfecho, la dependencia, los trastornos del estado de ánimo y la marginación social son algunos de los motivos por los que estos pacientes acumulan un pico de mortalidad en este momento de su vida(2).
La transición a una Unidad de Cardiopatías Congénitas del Adulto (UCCA) pretende dar continuidad a los cuidados específicos que precisa la población de pacientes seguidos en servicios de cardiología infantil u otros distintos, normalizando y sistematizando la atención de los problemas de salud genuinos en este grupo de pacientes, para evitar que dicha transición se produzca de una manera traumática o en periodos de inestabilidad clínica, y con ello prevenir el deterioro de la asistencia médica y las posibles consecuencias negativas de los cambios de forma en los cuidados(2).
La estrategia de la transición a la UCCA se hace extensiva a todos los pacientes que, habiendo alcanzado la mayoría de edad, una madurez intelectual suficiente, a petición del propio paciente o por remisión desde otros servicios o unidades de cardiología infantil, precisen seguimiento de sus cuidados en un servicio de cardiología de adultos por necesidades técnicas, legales, psicológicas o asistenciales.
Las principales asociaciones científicas han publicado guías para estandarizar las mejores prácticas en la transición, destacando la necesidad de coordinación y preparación adecuada
Con carácter general, pero sin ser excluyente en ningún caso, los pacientes cuyos cuidados en cardiología infantil se debían a cardiopatías adquiridas, alteraciones electrofisiológicas, miocardiopatías o cardiopatías familiares, en numerosas ocasiones también deben ser incluidos en programas de transición para pasar posteriormente a las unidades específicas de los servicios de cardiología de adultos.
Dada la creciente importancia en número, complejidad y recursos necesarios para poder atender este proceso de transición, las principales asociaciones científicas en el mundo de la cardiología, la American Heart Association(3) y la Sociedad Europea de Cardiología(4) han publicado recientemente unas guías con recomendaciones que pretenden estandarizar las mejores prácticas en este sentido.
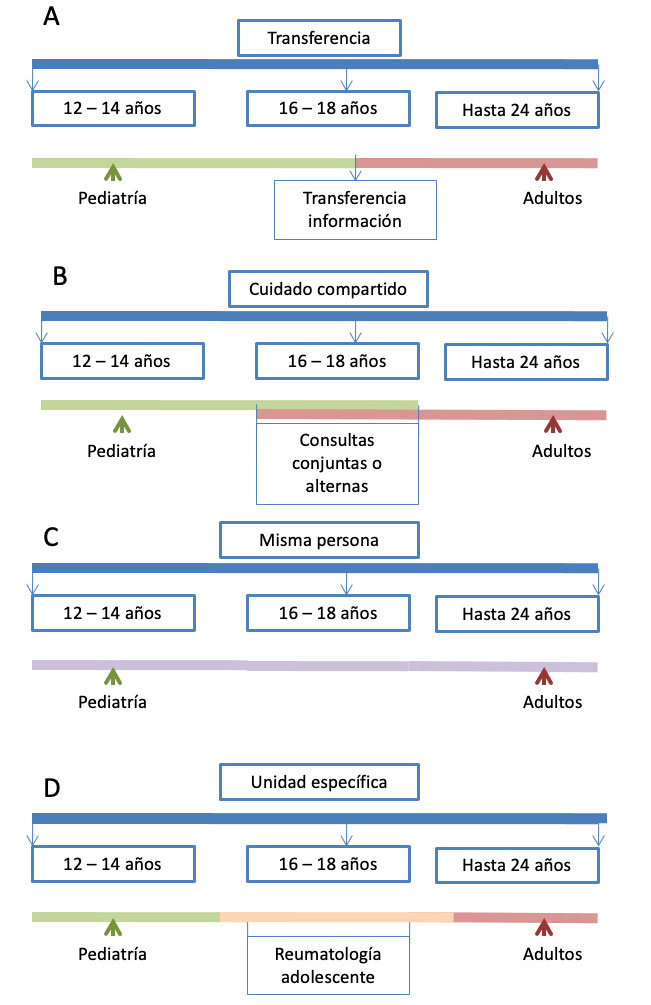
Definiciones y cronología
El proceso de transición puede seguir diversos modelos, pero todos deben centrar al paciente y abordar tanto cuestiones cardiológicas como otros aspectos de salud desde la adolescencia hasta la transferencia a unidades de adultos
La transición es un proceso prolongado desde el punto de vista temporal, que comienza con la más pronta adolescencia y que incluye la trasferencia en un momento concreto del paciente a los cuidados del adulto (Figura 2). No solo contempla la migración de los propios cuidados del enfermo, sino de su familia acompañante antes y después del momento de la trasferencia. La presentación y contacto con el equipo que cuidará del paciente en la vida adulta ha de producirse con anterioridad a este momento “de facto” y las competencias que deberá ir adquiriendo el paciente de manera gradual para lograr su empoderamiento se irán implementado de una manera individualizada basándose en la complejidad de la cardiopatía, el nivel cognitivo y los deseos de la familia.
Figura 2: Cronología y distribución temporal de las etapas de la transición en CC propuesto en las últimas guías de la Sociedad Europea de Cardiología(4)
Fuente: Modificado de (4) Moons P, Bratt EL, De Backer J, Goossens E, Hornung T, Tutarel O, et al. Transition to Adulthood and Transfer to Adult Care of Adolescents With Congenital Heart Disease.
Desafíos en la transición
La transición es un periodo vulnerable debido al desconocimiento de la enfermedad, pérdida de seguimiento, y otras complicaciones no cardiológicas, como trastornos del estado de ánimo y limitaciones funcionales
Las cardiopatías congénitas abarcan una amplia gama de anomalías estructurales y funcionales del corazón, que pueden variar desde defectos simples hasta anomalías complejas y multifactoriales. La complejidad de estas condiciones puede dificultar la comprensión por parte de los pacientes y sus familias, lo que a su vez puede afectar la capacidad de autogestión y toma de decisiones durante la transición a la atención para adultos. Además, las cardiopatías congénitas pueden requerir múltiples intervenciones médicas y quirúrgicas a lo largo de la vida del paciente, lo que agrega una carga adicional de complejidad a la toma de decisiones. En función de la complejidad de la CC, la transición y seguimiento en centros terciarios con unidades específicas es recomendada para cardiopatías de moderada y gran complejidad según la clasificación de Bethesda (Tabla I).
Tabla I. Clasificación de las CC según su complejidad
CIA: comunicación interauricular. CIV: comunicación interventricular. Canal AV: canal auriculoventricular. TSVD: tracto de salida del ventrículo derecho.
Fuente: Elaboración propia.
La preparación inadecuada tanto para los pacientes como para los proveedores de atención médica es un obstáculo importante, quizá el que más, en la transición exitosa de la atención pediátrica a la atención para adultos. Muchos pacientes y familias pueden no estar familiarizados con el proceso de transición o pueden subestimar su importancia. De hecho, muchos padres creen que los cuidados se van a perpetuar en el medio pediátrico o creen por el contrario que el seguimiento finaliza al cumplir la mayoría de edad(5). Sin duda el primer y principal impedimento para una transición satisfactoria es el propio desconocimiento del paciente y su familia de los detalles de su propia enfermedad. Del mismo modo, los especialistas involucrados pueden carecer de recursos y capacitación para abordar las necesidades específicas de los pacientes en transición. La falta de cardiólogos con formación apropiada y dedicada a las cardiopatías congénitas en nuestro medio es un grave problema estructural, derivado de, entre otros, la falta de reconocimiento por parte del Ministerio de Educación y del Ministerio de Sanidad de las subespecialidades pediátricas. Esta falta de preparación puede resultar en una interrupción en la atención y una pérdida de continuidad en el manejo de la enfermedad, lo que a su vez puede tener consecuencias negativas para la salud a largo plazo.
Uno de los objetivos clave de la transición en CC es promover la autonomía y el autocuidado en los pacientes adolescentes a medida que asumen la responsabilidad de su propia atención médica. Sin embargo, este proceso puede ser desafiante y requiere tiempo y apoyo adecuados. Los pacientes adolescentes deben aprender a gestionar su propia salud, incluida la toma de medicamentos, el seguimiento de citas médicas y la comunicación efectiva con los proveedores de atención médica. Esto puede ser especialmente difícil para aquellos que han estado acostumbrados a depender de sus padres o cuidadores para la coordinación de la atención médica. En una época donde la digitalización y las formas de comunicación entre pacientes y cuidadores están cambiando, no podemos dejar de contar con las nuevas tecnologías que pueden ayudarnos en este proceso, teniendo en cuenta precisamente que los medios digitales les son más familiares y amigables a las personas en la adolescencia. Existen de hecho experiencias iniciales con aplicaciones móviles especialmente dedicadas a este respecto que ordenan en una interfaz sencilla muchos de los procesos y contenidos de proceso de transición y ayudan a monitorizar los hitos alcanzados(6).
Es crucial educar a los pacientes adolescentes sobre su enfermedad y fomentar su autonomía en el autocuidado y toma de decisiones
La coordinación efectiva de la atención es fundamental para garantizar una transición sin problemas de la atención pediátrica a la atención para adultos. Esto implica la comunicación abierta y la colaboración entre los Cardiólogos infantiles y de adultos, así como la transferencia de información relevante sobre la historia clínica del paciente, el plan de tratamiento y las necesidades específicas de atención. Es aquí donde el papel de la enfermería de enlace es más importante. La falta de coordinación puede llevar a una atención fragmentada y a una pérdida de continuidad en el manejo de la enfermedad, lo que puede tener consecuencias negativas para la salud y el bienestar del paciente.
Aspectos no cardiológicos en la transición
Muchos pacientes requieren apoyo psicológico durante la transición y en su etapa adulta debido a los desafíos únicos que enfrentan en comparación con sus pares sin CC
El proceso de transición coincide con una adolescencia en muchos aspectos diferente para los pacientes con CC. Los aspectos psicológicos, sociales, vocacionales, de identidad, abuso de sustancias, etc… cobran protagonismo al mismo tiempo que pueden dificultar la relación del paciente con sus padres y sus cuidadores. Muchos de estos pacientes precisan o precisarán apoyo psicológico durante el proceso de transición y durante su etapa como adultos con CC.
Por otro lado, asociadas o derivadas de la propia CC, comienzan a aparecer durante el proceso de transición otras enfermedades o problemas de salud que pueden precisar valoración específica y seguimiento por primera vez en unidades de adultos (Figura 3) y que tienen que estar también ordenadas y contempladas en el proceso de transición aunque la primeras visitas sean en consultas de adultos(7).
Figura 3. Comorbilidades frecuentes en pacientes con CC(7)
Fuente: Modificado de (7) Lui GK, Saidi A, Bhatt AB, Burchill LJ, Deen JF , Earing MG, et al. Diagnosis and management of noncardiac complications in adults with congenital heart disease: a scientific statement from the American Heart Association. Circulation. 2017; 136(20):e348e392.
Programas de transición y responsabilidades
Los programas de transición deben garantizar una continuidad en los cuidados y evitar interrupciones que pueden tener consecuencias negativas a largo plazo
La transición es un proceso complejo desde el punto de vista médico y logístico. Existen diversos modelos que comparten los siguientes fundamentos.
Planificación anticipada
La planificación anticipada de la transición debe comenzar en la infancia temprana y adaptarse a medida que el paciente crece y se desarrolla. Esto incluye la identificación de las necesidades médicas, psicosociales y educativas del paciente, así como el desarrollo de un plan de transición individualizado que aborde estas necesidades de manera integral ya por parte de los cardiólogos infantiles. El plan de transición debe ser revisado y actualizado regularmente para garantizar su relevancia y efectividad a lo largo del tiempo.
Educación y empoderamiento
La educación continua para pacientes y familias es esencial para mejorar la comprensión de la enfermedad y fomentar la autonomía y el autocuidado. Esto puede incluir la provisión de información sobre la naturaleza de la enfermedad, el manejo de medicamentos, la programación de citas médicas y la comunicación efectiva con los proveedores de atención médica. Los recursos educativos, como folletos, sitios web y grupos de apoyo, pueden ser útiles para complementar la educación proporcionada por los profesionales de la salud.
Coordinación de la atención
La enfermería desempeña un papel clave en la coordinación del proceso, asegurando que se completen las fichas de traspaso y que se humanicen las dudas y preguntas de los pacientes
La coordinación efectiva de la atención es fundamental para garantizar una transición sin problemas de la atención pediátrica a la atención para adultos. Esto implica la colaboración entre equipos pediátricos y de adultos, así como la designación de un coordinador de transición que pueda servir como punto de contacto central para pacientes, familias y médicos durante el proceso de transición. El coordinador de transición puede ayudar a facilitar la comunicación, coordinar los servicios de apoyo y resolver problemas o preocupaciones que surjan durante la transición. El coordinador, normalmente personal de enfermería, debe encargarse de la supervisión de los hitos alcanzados. Puede ser de utilidad la cumplimentación supervisada de una hoja de ruta o ficha de transición a la UCCA(8).
Apoyo multidisciplinario
Un enfoque multidisciplinario que involucre a una variedad de profesionales de la salud es crucial para abordar las necesidades complejas de los pacientes en transición. Esto puede incluir cardiólogos pediátricos y para adultos, enfermeras, trabajadores sociales, psicólogos, terapeutas ocupacionales y otros especialistas. Estos profesionales pueden proporcionar apoyo emocional, educación y recursos prácticos para ayudar a los pacientes y sus familias a navegar por el proceso de transición de manera efectiva.
Tabla II. Actores principales en la transición a la UCCA y sus responsabilidades
Fuente: Elaboración propia.
Bibliografía
- Bouma BJ, Sieswerda GT, Post MC, Ebels T, van Kimmenade R, de Winter RJ, et al. New developments in adult congenital heart disease. Neth Heart J 2020; 28:449.
- Moceri P, Goossens E, Hascoet S, Checler C, Bonello B, E Ferrari E, et al. From adolescents to adults with congenital heart disease: the role of transition. Eur J Pediatr 2015; 174:847–54.
- John AS, Jackson JL, Moons PH, Uzark K, Mackie AS, Timmins S, et al. Advances in Managing Transition to Adulthood for adolescents with Congenital Heart Disease: A Practical Approach to Transition Program Design: A Scientific Statement from the American Heart Association. J Am Heart Assoc. 2022 Apr 5; 11(7): e025278.
- Moons P, Bratt EL, De Backer J, Goossens E, Hornung T, Tutarel O, et al. Transition to Adulthood and Transfer to Adult Care of Adolescents With Congenital Heart Disease: A Global Consensus Statement of the ESC Association of Cardiovascular Nursing and Allied Professions (ACNAP), the ESC Working Group on Adult Congenital Heart Disease (WG ACHD), the Association for European Paediatric and Congenital Cardiology (AEPC), the Pan-African Society of Cardiology (PASCAR), the Asia-Pacific Pediatric Cardiac Society (APPCS), the Inter-American Society of Cardiology (IASC), the Cardiac Society of Australia and New Zealand (CSANZ), the International Society for Adult Congenital Heart Disease (ISACHD), the World Heart Federation (WHF), the European Congenital Heart Disease Organisation (ECHDO), and the Global Alliance for Rheumatic and Congenital Hearts (Global ARCH). Eur Heart J 2021; 00:1-11.
- Wray J, Frigiola A, Bull C. Loss to specialist follow-up in congenital heart disease; out of sight, out of mind. Heart 2013; 99:485–90.
- Lopez KN, O’Connor M, King J, Alexander J, Challman M, Lovick DK, et al. Improving transitions of care for young adults with congenital heart disease: mobile APP development using formative research. JMIR Form Res 2018; 2.
- Lui GK, Saidi A, Bhatt AB, Burchill LJ, Deen JF , Earing MG, et al. Diagnosis and management of noncardiac complications in adults with congenital heart disease: a scientific statement from the American Heart Association. Circulation. 2017; 136(20):e348e392.
- Mackie AS, Rempel GR, Kovacs AH, Kaufman M, Rankin KN, Jelen A, et al. Transition intervention for adolescents with congenital heart disease. J Am Coll Cardiol 2018; 71:1768–77.
No existen conflictos de interés en la realización de este artículo.